
- •Основные понятия термодинамики. Термодинамические системы, состояния и характеристики. Термодинамические процессы
- •2 Первое начало термодинамики
- •3 Первое начало термодинамики для различных термодинамических процессах
- •4 Работа расширения газа при различных термодинамических процессах
- •7 Теплоемкости веществ зависимость теплоты реакции от температуры уравнение Кирхгофа
- •2 Реакция нейтрализации
- •9 Второе начало термодинамики Энтропия
- •10Связьэнтропии с теплотой обратимого процесса математическое выражение второго начала термодинамики цикл Карно
- •11 Изменение энтропии в обратимых и необратимых процессах
- •12 Статистическая энтальпия
- •13 Третье начало термодинамики Расчет изменения энтропии при нагревании системы изотермическое расширение и сжатии газа и фазовых переходах Абсолютная энтропия
- •14Понятие о термодинамических потенциалах Закрытые системы изотермо- изохорные процессы свободная энергия Гельмгольца
- •15 Закрытые системы изотермо-изобарные процессы свободная энергия Гиббса для обратимых и необратимых процессов
- •Свободная энергия и направление
- •Изменение свободной энергии при изменении температуры и давлении
- •Расчет изменения энергии Гиббса в химических реакциях Стандартная энергии Гиббса образования и сгорания веществ
- •Химический потенциал
- •Равновесное состояние Закон действующих масс
- •21Энергия Гиббса Химических реакций
- •22Стандартное изменение Гиббса химической реакции зависимость dGр-ц от концентрации участников реакции
- •23 Закон Гесса для канстанты равновесия
- •24 Зависимость константы равновесия реакции от t
- •25 Принцип ле Шателье Влияние изменения давления на химическое равновесие
- •26 Фазовое равновесие, основные понятия и условия фазового равновесия
- •27 Правило фаз Гибсса
- •28 Уравнение клаузиса-клайперона общая форма
- •29 Зависимость давления насыщенного пара от температуры
- •67.Гальванические элементы и их электродвижущая сила (эдс)
- •68.Концентрационные цепи
- •69. Потенциометрия. Определение рН р-ров.
- •70.Средняя и мгновенная скорость хим. Р-ций. Закон действующих масс (здм) для скоростей. Константа скорости р-ции и период полупревращения.
- •71. Молекулярность и порядок р-ции.
- •74. Кинетика параллельных р-ций.
- •75. Кинетика последовательных р-ций 1-го порядка.
- •76.Кинетика обратимых р-ций 1-го порядка.
- •77. Кинетика сопряженных и цепных р-ций.
- •78. Влияние т на скорость х. Р. Правило Вант-Гоффа
- •80. Ур. Аррениуса. Определение энергии активации.
- •81. Катализ. Особ. Катализа. Мех-м….. Катализаторами
74. Кинетика параллельных р-ций.
Параллельными
называются р-ции типа ![]() , в ходе кот. одно в-во дает начало
двум другим парал. р-циям. Пример,
разложение бертолетовой соли
, в ходе кот. одно в-во дает начало
двум другим парал. р-циям. Пример,
разложение бертолетовой соли
К парал. р-циям относят также множ-во р-ций, встречающихся в органич. химии. Например, р-ция нитрования фенола, в ходе кот. параллельно образуется пара- и ортонитрофенолы.
Кинетич. ур-ние для парал. р-ций записывается с учетом принципа независимости хим. р-ции
![]() .
Решение
этого ур-ния записывается аналогично
простым р-циям 1-го порядка
.
Решение
этого ур-ния записывается аналогично
простым р-циям 1-го порядка ![]()
Кинетич. кривая. Отношение равновесных конц-ций
продуктов парал. р-ций есть величина постоянная,
зависящая от констант скоростей этих р-ций.
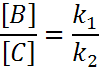
75. Кинетика последовательных р-ций 1-го порядка.
Последовательными
наз. р-ции,
протекающие ч/з ряд промежуточных стадий
![]() .
На этой схеме буквами обозначаются
стадии последоват. р-ций. В общем случае
число ступеней в последоват. р-циях м.б.
более 3-ёх, причем каждая из них м.б. не
молекулярной, а более сложной. К р-циям
этого типа относят р-ции гидролиза
сложных эфиров, сложных эфиров гликолей
и дихлорпроизводных. Примером последоват.
р-ций явл. р-ция разложения трисахарида
рафинозы, протекающая ч/з стадию
образования дисахарида и заканч-ся
образованием моносахарида.
.
На этой схеме буквами обозначаются
стадии последоват. р-ций. В общем случае
число ступеней в последоват. р-циях м.б.
более 3-ёх, причем каждая из них м.б. не
молекулярной, а более сложной. К р-циям
этого типа относят р-ции гидролиза
сложных эфиров, сложных эфиров гликолей
и дихлорпроизводных. Примером последоват.
р-ций явл. р-ция разложения трисахарида
рафинозы, протекающая ч/з стадию
образования дисахарида и заканч-ся
образованием моносахарида.
1.![]()
рафиноза дисахарид
2.![]()
моносахарид
Расчет кинетики последоват. р-ций можно произвести если принять, что в начальн. момент времени есть только в-во А. Применим к этой системе з-п действующих масс и принцип независимости хим. р-ции.
![]() для 1-ой р-ции
для 1-ой р-ции
![]() для 2-ой р-ции
для 2-ой р-ции
![]() для 3-ей р-ции
для 3-ей р-ции
![]()
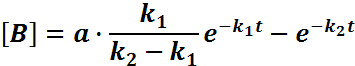
Причем конц-ция
промежуточного в-ва В
будет
достигать максимум при условии 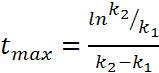 ,
а величина этого максимума будет зависеть
от соотношения
Рассмотрим кинетич. кривые. Если
соотношение
,
а величина этого максимума будет зависеть
от соотношения
Рассмотрим кинетич. кривые. Если
соотношение 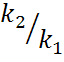 мало,
т.е.
мало,
т.е. ![]() ,
,
то образование промежуточного
в-ва В происходит быстро, а его
расходование – медленно.
Если
велико,
т.е.![]() и образование промежуточного в-ва В
не происходит
и оно быстро превращается в в-во С.
и образование промежуточного в-ва В
не происходит
и оно быстро превращается в в-во С.
76.Кинетика обратимых р-ций 1-го порядка.
Обратимыми
называются
такие р-ции, скорость кот. равна разности
м/у скоростями прямой и обратной
р-ции.Например,![]() -
р-ция этерификации.
-
р-ция этерификации. ![]() .
Вывод кинетич.
ур-ния рассмотрим на примере обратимой
р-ции 1-го порядка
.
Вывод кинетич.
ур-ния рассмотрим на примере обратимой
р-ции 1-го порядка ![]() .Тогда
кинетич. ур-ние
.Тогда
кинетич. ур-ние ![]()
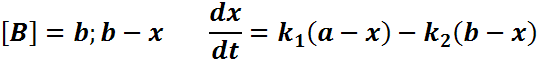
Решение этого
ур-ния можно выразить ч/з степень
превращения, кот. соответствует достижению
равновесия- ![]() .
Тогда
.
Тогда ![]() .
Если
.
Если ![]() то
в р-ции наступает равновесие, кот.
описывается
то
в р-ции наступает равновесие, кот.
описывается ![]() .
.
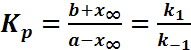
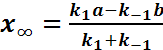
Кинетич. кривые р-ции 1-го порядка
77. Кинетика сопряженных и цепных р-ций.
Сопряженными
наз. те р-ции,
одна из кот. будучи самопроизвольной
вызывает протекание 2-ой р-ции , невозможной
в отсутствии 1-ой. ![]() .
Явление, лежащее в основе протекания
сопряженных р-ций наз.
хим. индукцией.Сопряженные
р-ции протекпют ч/з общие активные
промежуточные в-ва, кот. товетственны
за явление хим. индукции. Например,
бензол, кот.
не окисл-ся в
.
Явление, лежащее в основе протекания
сопряженных р-ций наз.
хим. индукцией.Сопряженные
р-ции протекпют ч/з общие активные
промежуточные в-ва, кот. товетственны
за явление хим. индукции. Например,
бензол, кот.
не окисл-ся в ![]() ,
в присутствии
,
в присутствии ![]() превращается в фенол и дифенил.
превращается в фенол и дифенил.
![]()
![]()
![]()
![]()
![]()
Обе р-ции ок-ния
![]() и бензола
протекают с участием общего промежуточного
свободного радикала и явл. сопряженными.
и бензола
протекают с участием общего промежуточного
свободного радикала и явл. сопряженными.
К цепным относится группа р-ций, протекающих путем образования цепи следующих друг за другом р-ций, в кот. участвуют активн. частицы с ненасыщ своб. валентностями, так называемые свободные радикалы.Свободный радикал образуется за счет дополнит. поглощения энергии при разрыве связи в молекуле, а также при электрич. разрыве связи, при электромагнитном колебании и за счет др. внешн. источников энергии. Свободными радикалами явл. валентные ненасыщ. частицы, кот. можно представить как осколки молекул.
Также радикалами м.б. свободные атомы, поскольку своб. радикалы имеют неспаренные электроны, они явл. чрезвычайно реакционно способными. Сущность цепного механизма заключается в том, что активн. молекула, реагируя, порождает новую активн. молекулу. Процесс исчезновения и регенерации каждой активн. частицы циклически повторяется много раз, что создает цепь превращений, совершающихся частью параллельно, а частью – последовательно. Для всех цепных р-ций характерны 3 стадии:1. зарождение цепи, 2. развитие цепи, 3. обрыв цепи.
Например, ![]() зарождение
зарождение
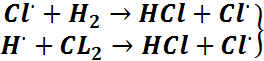 развитие
цепи
развитие
цепи
![]() обрыв цепи
обрыв цепи
Стадия первичного образования активных частиц идет при поглощении квантов света или при высоких темпер-ах. Превращение исходных в-в в конечный продукт протекает ч/з последоват. цепь элементарных актов, что можно представить следующей схемой
Отдельные р-ции, лежащие в основе этой цепи носят название звеньев. Длина цепи определяется кол-вом звеньев. В зав-ти от природы реагирующих в-в длина цепи может колебаться от 2-3 звеньев до неск. тысяч и более. Зародившаяся цепь не может развиваться бесконечно, т.к. для любой цепной р-ции имеет место процессы разрушения активных центров (свободных радикалов), что вызывает обрыв цепи. Обрыв цепи может происходить в результате потери активности радикалом или при столкновении активн. частицы со стенками сосудов. Цепные р-ции бывают 3-ёх типов:1.простые (образование HCl), 2. разветвленные, 3. сплошьразветвленные.
Если в каждом звене цепи на каждый исчезнувший центр приходится не более одного вновь возникающего, то это простая цепная р-ция. Если в одном звене на исчезнувший активный центр приходится более одного нового центра, то р-ция разветвленная. В предельном случае разветвление осуществляется на каждом звене цепи- это сплошьразветвленные р-ции.
