
- •Химические свойства кислот и оснований.
- •Номенклатура и химические свойства солей.
- •Комплексные соединения: номенклатура, состав и химические свойства.
- •Ионообменные реакции с участием осадков и газов.
- •5. Ионообменные реакции с участием слабых электролитов и комплексных ионов.
- •Степень окисления. Окислительно-восстановительные реакции.
- •Гидролиз соли, образованной сильной кислотой и слабым основанием. Степень гидролиза
- •Гидролиз соли, образованной слабой кислотой и сильным основанием.
- •Гидролиз соли, образованной слабой кислотой и слабым основанием.
- •Случаи полного гидролиза.
- •Термохимия. Тепловой эффект реакции. Термохимические уравнения. Закон Гесса.
- •Термохимия. Энтальпия образования реагента. Вычисление теплового эффекта.
- •Химическая термодинамика. Функции процесса и состояния. Энтропия. Энергия Гиббса.
- •Химическая термодинамика. Определение направления протекания реакциипо изменению её энергии Гиббса. Энтальпия образования реагента.
- •Химическое равновесие. Константа равновесия гомогенных и гетерогенных реакций.
- •Химическое равновесие. Принцип ЛеШателье. Смещение равновесия при изменении температуры.
- •Химическое равновесие. Принцип ЛеШателье. Смешение равновесия при изменении общего давления.
- •Химическое равновесие. Принцип ЛеШателье. Смещение равновесия
- •Равновесия в растворах электролитов. Сильные и слабые электролиты.
- •Равновесия в растворах электролитов. Степень иконстанта диссоциации слабого электролита.
- •Равновесия в растворах электролитов. Ионное произведение воды. Водородный показатель.
- •Равновесия в растворах электролитов. Произведение растворимости.
- •Равновесия в растворах электролитов. Константы нестойкости комплексного иона.
- •Химическая кинетика. Зависимость скорости реакции от температуры.
- •Химическая кинетика. Зависимость скорости реакции от концентрации реагирующих веществ. Молекулярность и порядок реакции. Лимитирующая стадия реакции.
- •26 Химическая кинетика применительно к гетерогенным системам.
- •Химическая кинетика. Гомогенный и гетерогенный катализ. Автокатализ.
- •Электрохимия. Уравнение Нернста. Потенциал металлического электрода.
- •Электрохимия. Водородный электрод и ряд напряжений.
- •Электрохимия. Уравнение Нернста.
- •31. Электрохимия. Гальванический элемент.
Химическое равновесие. Константа равновесия гомогенных и гетерогенных реакций.
Константа
равновесия гомогенных и гетерогенных
реакций.
Обратимые реакции текут до состояния
химического равновесия. Признаки,
характеризующие состояние химического
равновесия: 1) Скорость прямого процесса
равна скорости обратного; 2) Неизменность
равновесного состояния при сохранении
внешних условий; 3) Динамичность
(способность равновесия восстанавливаться
при небольших смещениях внешних условий)
4)
 (
(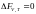 ).
).
После наступления химического равновесия концентрации исходных веществ и продуктов реакции становятся неизменными.
Закон
действия масс: отношение произведения
равновесной концентрации продуктов
реакции к произведению равновесной
концентрации исходных веществ в степенях,
равным стехиометрическим коэффициентам,
постоянна. ,
где Кс
– константа равновесия.
,
где Кс
– константа равновесия.
Константа
равновесия гетерогенной реакции:

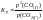 .
.
Химическое равновесие. Принцип ЛеШателье. Смещение равновесия при изменении температуры.
Если на равновесную систему оказываются внешние воздействия, то в ней пойдут процессы, понижающие это воздействие.
Влияние температуры: повышение температуры смещает равновесие в сторону процесса идущего с поглощением тепла (эндотермический процесс); понижение температуры; понижение температуры приводит к противоположному результату.
Зависимость константы равновесия от температуры в конденсированных системах описывается уравнением изобары Вант-Гоффа:
![]()
в системах с газовой фазой — уравнением изохоры Вант-Гоффа
![]()
В небольшом диапазоне температур в конденсированных системах связь константы равновесия с температурой выражается следующим уравнением:
![]()
Химическое равновесие. Принцип ЛеШателье. Смешение равновесия при изменении общего давления.
Если на равновесную систему оказываются внешние воздействия, то в ней пойдут процессы, понижающие это воздействие.
Влияние давления: рост давления смещает равновесие в сторону меньшего числа молей, т.е. в сторону падения давления. Уменьшение давления смещает равновесие в сторону увеличения числа молей (учитываются только моли газов).
Химическое равновесие. Принцип ЛеШателье. Смещение равновесия
при изменении концентрации (парциального давления) одного из реагирующих веществ.
Если на равновесную систему оказываются внешние воздействия, то в ней пойдут процессы, понижающие это воздействие.
Влияние концентрации: .
При увеличении концентрации
.
При увеличении концентрации
 или
или равновесие смещается в сторону реакции,
потребляющей эти вещества, т.е. вправо.
При увеличении концентрации
равновесие смещается в сторону реакции,
потребляющей эти вещества, т.е. вправо.
При увеличении концентрации
 равновесие смещается влево.
равновесие смещается влево.
Равновесия в растворах электролитов. Сильные и слабые электролиты.
Сильные электролиты при растворении в воде практически полностью диссоциируют на ионы независимо от их концентрации в растворе.
Поэтому в уравнениях диссоциации сильных электролитов ставят знак равенства (=).
К сильным электролитам относятся:
- растворимые соли;
- многие неорганические кислоты: HNO3, H2SO4, HCl, HBr, HI;
- основания, образованные щелочными металлами (LiOH, NaOH, KOH и т.д.) и щелочно-земельными металлами (Ca(OH)2, Sr(OH)2, Ba(OH)2).
Слабые электролиты в водных растворах лишь частично (обратимо) диссоциируют на ионы.
Поэтому в уравнениях диссоциации слабых электролитов ставят знак обратимости (⇄).
К слабым электролитам относятся:
- почти все органические кислоты и вода;
- некоторые неорганические кислоты: H2S, H3PO4, H2CO3, HNO2, H2SiO3 и др.;
- нерастворимые гидроксиды металлов: Mg(OH)2, Fe(OH)2, Zn(OH)2 и др.
Для сильных электролитов в водном растворе по определению α = 1: диссоциация таких электролитов протекает необратимо (до конца), и степень превращения растворенного вещества в ионы полная. Для слабых электролитов степень диссоциации (отношение молярной концентрации продиссоциировавшего вещества cд к общей концентрации вещества cB в растворе):
α = cд / cB
всегдаменьше единицы, но больше нуля (0 < α < 1).
