
- •1.Закономерности излучения черного тела. Законы Кирхгофа, Стефана-Больцмана, Вина. Формула Рэлея-Джинса. Ультрафиолетовая катастрофа.
- •2.Энергия и импульс фотона. Формула Планка для спектра излучения черного тела.
- •3.Квантовая теория фотоэффекта. Эффект Комптона.
- •4.Давление света. Опыты, подтверждающие давление света. Корпускулярно-волновой дуализм излучения.
- •6.Волновой пакет микрочастицы. Соотношение неопределенностей Гейзенберга.
- •7.Опыты Резерфорда по рассеянию -частиц. Формула Резерфорда. Модель атома Резерфорда-Бора.
- •8.Закономерности в спектрах атома водорода. Серии Лаймана, Бальмера, Пашена. Комбинационный принцип Ритца.
- •9.Дискретность квантовых состояний атома. Постулаты Бора. Опыты Франка-Герца.
- •10.Спонтанные и вынужденные переходы. Коэффициенты Эйнштейна. Спектральная плотность излучения.
- •11.Принцип работы лазера. Типы лазеров. Свойства лазерного излучения.
- •12. Волновая функция микрочастицы и ее свойства. Стационарное и нестационарное уравнение Шредингера.
- •13. Решение уравнения Шредингера для свободной микрочастицы и находящейся в потенциальной яме.
- •14. Прохождение микрочастицы через потенциальный барьер. Туннельный эффект.
- •15. Гармонический осциллятор. Квантомеханическое описание атома водорода.
- •16. Уровни энергии и схема термов щелочных металлов. Дублетная структура спектров щелочных металлов.
- •17. Магнитный и механический моменты электронов. Спин. Опыты Штерна и Герлаха.
- •18. Результирующий механический момент многоэлектронного атома. J-j и l-s связь.
- •19. Нормальный и аномальный эффекты Зеемана. Фактор Ланде.
- •20. Электронные оболочки атома и их заполнение. Принцип Паули. Правила Хунда.
- •21. Тормозное и характеристическое рентгеновское излучение. Закон Мозли.
- •22. Физические особенности в молекулярных спектрах. Энергия и спектр двухатомной молекулы. P-, q- и r-ветви.
- •23. Одномерный кристалл Кронига-Пенни. Понятие о зонной теории твердых тел. Распределения Ферми-Дирака и Бозе-Эйнштейна. Фермионы и бозоны.
- •26.Свойства и характеристика ядер. Нейтрон и протон, их свойства. Энергия связи ядра.
- •27.Свойства и модель ядерных сил. Капельная модель ядра. Формула Вейцзеккера для энергии связи. Оболочечная модель ядра.
- •28. Искусственная и естественная радиоактивность. Основной закон радиоактивного распада. Активность. Правила смещения.
- •29. Основные закономерности -распада. Туннельный эффект. Свойства -излучения.
- •35.Источники и методы регистрации элементарных частиц. Типы взаимодействий и классы элементарных частиц. Античастицы.
- •37.Физическое, химическое и биологическое воздействие ионизирующего излучения.
8.Закономерности в спектрах атома водорода. Серии Лаймана, Бальмера, Пашена. Комбинационный принцип Ритца.
Для
одноэлектронного атома ( с одним
электроном на внешней оболочке, например,
атома водорода) значения энергий атома
в устойчивых состояниях могут быть
определены с помощью формулы
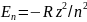
где R=2.28*10-18 Дж - постоянная Ридберга, z - заряд атомного ядра, n - главное квантовое число, которое и характеризует полную энергию электрона в поле ядра с зарядом ze , e- заряд электрона. Из этой формулы можно определить частоты излучения атома (частоты соответствующих спектральных линий) . Так для атома водорода.
Vnn`=R(1/n’2-1/n2)
Если варьировать значения квантовых чисел и , то можно получить спектральные серии водорода: Vnn`=R(1/n’2-1/n2)
n’=1, n=2,3,4,…,∞ серия Лаймана,
n’=2, n=3,4,5,…,∞ серия Бальмера.
n’=3, n=4,5,6…,∞ серия Ритца-Пашена,
Название этих серий соответствует именам ученых, экспериментально установивших эти закономерности в спектре атома водорода.
Комбинацио́нный при́нцип Ри́тца — основной закон спектроскопии, установленный эмпирически Вальтером Ритцем в 1908 году. Согласно этому принципу всё многообразие спектральных линий какого-либо элемента может быть представлено через комбинации неких величин, получивших название термы. Спектроскопическое волновое число (не путать с волновым вектором k) каждой спектральной линии можно выразить через разность двух термов:
![]() ;
;
Если зафиксировать ![]() и
перебирать все возможные значения
и
перебирать все возможные значения ![]() ,
то получится набор линий,
именуемый спектральной
серией.
Из комбинационного принципа следует,
что разность волновых чисел двух
спектральных линий одной и той же серии
атома даёт волновое число спектральной
линии какой-то другой серии того же
атома.
,
то получится набор линий,
именуемый спектральной
серией.
Из комбинационного принципа следует,
что разность волновых чисел двух
спектральных линий одной и той же серии
атома даёт волновое число спектральной
линии какой-то другой серии того же
атома.
Следствие комбинационного принципа: Разность волновых чисел двух спектральных линий одной и той же серии атома даёт волновое число спектральной линии какой-то другой серии того же атома. Доказательство: Рассмотрим две спектральные линии одной серии:
![]() ,
, ![]()
Пусть ![]() ,
тогда
,
тогда ![]() .
Вычитая второе равенство из первого
получаем
.
Вычитая второе равенство из первого
получаем
![]() .
.
9.Дискретность квантовых состояний атома. Постулаты Бора. Опыты Франка-Герца.
Модель Бора выявила истинное значение спектральных законов и позволила установить, как эти законы отражают квантовый характер внутренней структуры атома — устойчивость структуры атома оказалась неразрывно связанной с существованием квантов. В модели Бора каждый атом обладает некоторой последовательностью квантовых стационарных состояний. Каждый вид атома имеет свою последовательность квантовых значений энергии, соответствующих различным возможным стационарным состояниям.Постулаты Бора:
1. В атоме существует ряд дискретных стационарных состояний.В стационарном состоянии атом не излучает и не поглощает энергии.
2 .В стационарном состоянии атом электрона двигаясь по круговой орбите должен иметь квантованое значения импульса удовлетваряющего условию
Ln=mvτ=nh,n=1,2,3,…
n=2πr/λ
3.При переходе атома из одного стационарного состояния в другое испускается или поглощается один фатон.
∆Е=hυ
Опыт Франка — Герца — опыт, явившийся экспериментальным доказательством дискретности внутренней энергии атома.
В опыте наблюдался монотонный рост I при увеличении ускоряющего потенциала вплоть до 4,9 в, то есть электроны с энергией Е 4,9 эв испытывали упругие соударения с атомами Hg и внутренняя энергия атомов не менялась. При значении V = 4,9 в и кратных ему значениях 9,8 в, 14,7 в появлялись резкие спады тока. Это определённым образом указывало на то, что при этих значениях V соударения электронов с атомами носят неупругий характер, т. е. энергия электронов достаточна для возбуждения атомов Hg. При кратных 4,9 эв значениях энергии электроны могут испытывать неупругие столкновения несколько раз. Таким образом, опыт Франка — Герца показал, что спектр поглощаемой атомом энергии не непрерывен, а дискретен, минимальная порция квант электромагнитного поля, которую может поглотить атом Hg, равна 4,9 эВ. Значение длины волны = 253,7 нм свечения паров Hg, возникавшее при V 4,9 В, оказалось в соответствии со вторым постулатом Бора.
