
- •1. Происхождение и смысл понятия «Синергетика».
- •2.Отличие подходов в кибернетике и синергетике.
- •3. Что такое Диссипативная структура?
- •4. Что такое Фрактал?
- •5. Принцип порядка Больцмана.
- •6. Два принципа асимметрии природы на примерах преобразования энергии.
- •7 Соотношение взаимности Онсагера
- •8 Теорема о минимуме производства энтропии и вытекающие из нее выводы
- •9. Критерий эволюции.
- •10. Соотношение, связывающее условия термодинамической устойчивости с кинетикой химических реакций.
- •11. Упрощенный механизм образования шестигранных ячеек в модели Бенара.
- •12. Примеры решения задач нелинейной теплопроводности и их практическое применение (значение)
- •13. Составляющие энтропии в реакции окисления железа
- •14. Составляющие энтропии в реакции диссоциации
- •15 Реакция Белоусова-Жаботинского
- •16 Объяснение механизма самоорганизации мартеновской ванны
- •17. Схема механизма колебательности в металлургическом реакторе-осцилляторе.
- •18. Принцип наименьшего принуждения.
- •19 Принцип подчинения
- •20 Примеры микроосцилляторов в металлургии
- •21. Соотношение для критического размера диффузионной области
- •22 Отклонение от равновесия и бифуркации
- •23 Роль флуктуации в механизме самоорганизации
- •2 4 Уравнение динамики популяций, живущих за счет общего ресурса
- •25. Уравнение Ланжевена
- •26. Уравнение популяций типа хищник-жетва
17. Схема механизма колебательности в металлургическом реакторе-осцилляторе.
У прощенная
схема реактора представлена на рис.
Рассматриваем работу реактора на примере
продувки жидкого чугуна встречными
струями кислорода.
прощенная
схема реактора представлена на рис.
Рассматриваем работу реактора на примере
продувки жидкого чугуна встречными
струями кислорода.
В отличие от рассмотренного выше реактора, где имели место температурные колебания, здесь основную роль играют осцилляции давления, которые возникают вследствие того, что ведущую роль в этом процессе играют гетерогенные реакции прямого
[С]+ 0,5{O2}= {CO} (1)
и косвенного окисления углерода
[Fe]+ 0,5{O2}= (FeO) (2)
[C]+ (FeO) = [Fe]+ {CO}, (3)
в двух из которых образуется газообразный продукт.
Создав затруднения для истечения получающего при этом двухфазного потока q3 и учитывая сложную (нелинейную) зависимость критической скорости этого потока от газосодержания, которое в свою очередь зависит от характера протекающих в реакторе процессов, получаем пульсирующий характер изменения давления в реакторе. Качественная картина зависимости критической скорости истечения двухфазного потока vкр от объемного газосодержания представлена на рис. 4.18.
Рассматриваемые процессы протекают в области высоких объемных газосодержаний (заштрихованная область).
Величина газосодержания определяется соотношением
αг=Vco/(Vco+Vкф)
где – VСО и VКФ соответственно объемные расходы газообразной (оксид углерода) и конденсированной фазы, состоящей из капель железа и оксидов металлов.
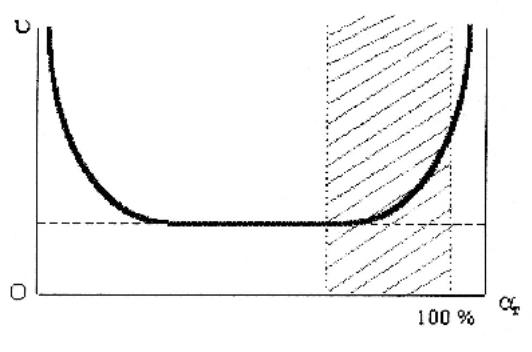
Рис. 4.18. Зависимость скорости двухфазного потока от объемного газосодержания
18. Принцип наименьшего принуждения.
Условия стабильности термодинамических систем, и прежде всего открытых, опредлюся принципом Ле Шателье-Брауна или принципом наименьшего принуждения.
Для его доказательства, применительно к релаксационным процессам вблизи равновесия, используется термодинамический критерий устойчивости в равновесном состоянии:
dG= -SdT+VdP+ΣmidNi.
Критерием химического равновесия при постоянных Т и Р является условие ΔG = 0.
Именно принцип наименьшего принуждения, позволяющий учитывать реакцию объекта на приложенные к нему внешние воздействия. является важнейшей отличительной чертой синергетического подхода к управлению по сравнению с кибернетическим.
В последнем же основное внимание уделяется достижению поставленной цели (минимальное время или минимальное динамическое отклонение и т.д.) за счет наиболее эффективного преобразования внешнего (по отношению к управляемому объекту) сигнала обратной связи, хотя свойства объекта (его передаточная функция) и здесь, естественно, определенным образом учитывается.
19 Принцип подчинения
Очень важный принцип, открывающий возможность выхода на параметры порядка. Рассмотрим простейшее эволюционное уравнение (используется для описания автокаталитических реакций):
q =αq .
С учетом флуктуирующих сил:
q(с точкой) =αq + f (t) .
В случае, если вещество 1 с концентрацией q1 образуется автокаталически из вещества 2 с концентрацией q2, то эволюционное уравнение для скорости образования вещества 1 имеет вид q(с точкой) = βq1q2 .
С учетом стохастичности:
q1(с точкой) =αq1 + βq1q2 + f (t).
Параметр β описывает связь между двумя системами q1 и q2, а если сила связи регулируется извне, то β играет роль управляющего параметра.
Для решения широкого класса стохастичских нелинейных дифференциальных уравнений в частных производных существует метод, позволяющий найти функцию q2 (t) = f (q1(t)) при одном и том же t. В этом случае переменная q2 подчинена переменной q1 (принцип подчинения), что
позволяет упростить сложную задачу. Рассмотрим это на примере, рис. 4.2, действия лазера и проточного высокотемпературного химического реактора (рис. 4.2).
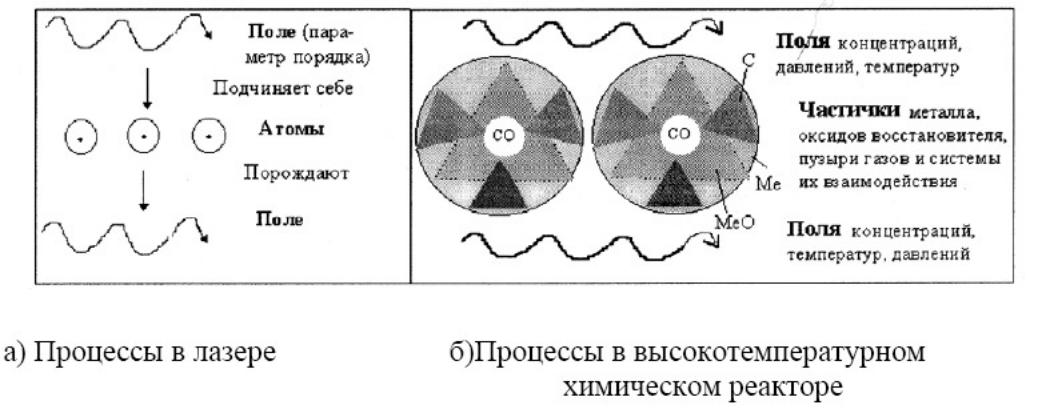
Рис. 4.2. Примеры круговой подчиненности
Принцип подчинения, который реализуется в самоорганизующихся системах, определяет отбор наиболее приспособленной моды, связанной с достижением критических условий. При этом множество переменных (например, атомов в лазере) подчиняется одной или нескольким переменным, выступающим как параметры порядка, например, параметры поля, которое в тоже время упорядочивающим образом действует на атомы (рис. 4.2а).
В проточном высокотемпературном реакторе в качестве такой переменной может выступать температура или давление, которое может оказывать тормозящее воздействие на химические реакции через парциальное давление в газовых пузырьках, а весь ансамбль пузырьков в то же самое время определяет давление в реакторе (рис.4.2б).
