
- •1. Происхождение и смысл понятия «Синергетика».
- •2.Отличие подходов в кибернетике и синергетике.
- •3. Что такое Диссипативная структура?
- •4. Что такое Фрактал?
- •5. Принцип порядка Больцмана.
- •6. Два принципа асимметрии природы на примерах преобразования энергии.
- •7 Соотношение взаимности Онсагера
- •8 Теорема о минимуме производства энтропии и вытекающие из нее выводы
- •9. Критерий эволюции.
- •10. Соотношение, связывающее условия термодинамической устойчивости с кинетикой химических реакций.
- •11. Упрощенный механизм образования шестигранных ячеек в модели Бенара.
- •12. Примеры решения задач нелинейной теплопроводности и их практическое применение (значение)
- •13. Составляющие энтропии в реакции окисления железа
- •14. Составляющие энтропии в реакции диссоциации
- •15 Реакция Белоусова-Жаботинского
- •16 Объяснение механизма самоорганизации мартеновской ванны
- •17. Схема механизма колебательности в металлургическом реакторе-осцилляторе.
- •18. Принцип наименьшего принуждения.
- •19 Принцип подчинения
- •20 Примеры микроосцилляторов в металлургии
- •21. Соотношение для критического размера диффузионной области
- •22 Отклонение от равновесия и бифуркации
- •23 Роль флуктуации в механизме самоорганизации
- •2 4 Уравнение динамики популяций, живущих за счет общего ресурса
- •25. Уравнение Ланжевена
- •26. Уравнение популяций типа хищник-жетва
8 Теорема о минимуме производства энтропии и вытекающие из нее выводы
использованы уравнения баланса массы, дифференциальное уравнение Гиббса и полученное на их основе уравнение баланса энтропии и физический смысл используемых в этих уравнениях величин ясны из рис. 2.6.
У равнение
баланса массы:
равнение
баланса массы:
![]() (2.1)
(2.1)
Приведем также дифференциальное уравнение Гиббса
![]() (2.2)
(2.2)
где μj – химический потенциал единицы массы компонента
Xj, Sυ – плотность энтропии, функция ρj.
Для случая равновесия это уравнение имеет следующий вид:
![]() (2.3)
(2.3)
где Т – температура;
U- внутренняя энергия; р – давление; m – масса.
На основе уравнений (2.1) и (2.2) может быть получено уравнение
баланса энтропии:
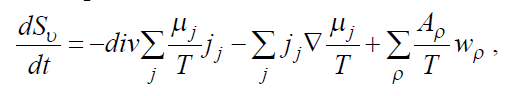 (2.4)
(2.4)
С учетом полученных соотношений далее выводится теорема о ми-
нимальном производстве энтропии (Р). получаем следующее соотношение:

Учитывая произвольность вариаций концентраций ρi, вытекает неравенство

Тогда следует, что
dP/dt < 0 – вдали от стационарного состояния;
dP/dt = 0 – в стационарном состоянии.
Изменение производства энтропии во времени представлено на рис.2.7, что и является графической иллюстрацией теоремы о минимальном производстве энтропии, на основе которой делаются следующие утверждения.
В линейных системах выполняется общее
неравенство, согласно которому в
стационарном неравновесном состоянии
производство энтропии имеет минимальное
значение, зависящее от внешних условий,
наложенных на систему.
линейных системах выполняется общее
неравенство, согласно которому в
стационарном неравновесном состоянии
производство энтропии имеет минимальное
значение, зависящее от внешних условий,
наложенных на систему.
При этом в системе могут иметь место возмущения либо внешней природы, обусловленные случайными или систематическими изменениями окружающей среды, либо внутренние флуктуации, возникающие в самой системе в результате межмолекулярного взаимодействия или случайного теплового движения частиц. В результате система непрерывно отклоняется на небольшую величину от макроскопического состояния, описываемого уравнениями баланса термодинамических переменных
9. Критерий эволюции.

Aρ зависит от природы элементов и от отклонения термодинамического равновесия.
 ,
где
,
где

j и Wρ связаны с ρi системой нелинейных уравнений феноменологических, например, типа

Разделим производство энтропии на 2 части

В линейной области
 – это
следствие теоремы о минимальном
производстве энтропии.
– это
следствие теоремы о минимальном
производстве энтропии.

 – универсальный
критерий эволюции
– универсальный
критерий эволюции
10. Соотношение, связывающее условия термодинамической устойчивости с кинетикой химических реакций.
Соотношение
δxP(λc)=0
при t≥t0
позволяет найти внешние условия
(управляющие воздействия), при которых
возникает неустойчивость термодинамической
ветви, и связать эти условия с кинетикой
химических реакций. Определение условий,
при которых может происходить потеря
термодинамической устойчивости, сводится
к определению знака величины δхР
или
в конечном итоге – знака величины

11. Упрощенный механизм образования шестигранных ячеек в модели Бенара.
Исторически первой моделью самоорганизации (формирования диссипативной структуры) являются так называемые ячейки Бенара, открытые в 1900 г. Постановка опыта очень проста: необходимо в равномерно подогреваемый снизу сосуд с плоским дном налить масло с размешанным в нем мелким порошком (рис. 3.1a).
П ока
разность температур у дна и на поверхности
ΔT
=
T1
-T2
невелика, жидкость неподвижна. Когда
эта разность превысит определенное
значение ΔTc
,
которое зависит от свойств жидкости и
толщины слоя, вся среда разбивается на
правильные шестигранные ячейки (рис.
3.1б), в центре каждой из которых жидкость
поднимается вверх, а по краям – вниз.
Центр тяжести элементарной ячейки
жидкости как бы поднимается вверх,
становится неустойчивым и опрокидывается.
Дальнейшее повышение разности температур
ΔТ приводит к разрушению ячеек и
хаотическому (турбулентному) движению
жидкости. Формирование именно шестигранных
ячеек объясняется на основе принципа
минимальной диссипации энергии, т.к.
только в этом случае имеет место
минимальное отношение поверхности к
объему.
Это весьма наглядный пример оптимального
решения, найденного природой (неживой
природой), реализуемого
ока
разность температур у дна и на поверхности
ΔT
=
T1
-T2
невелика, жидкость неподвижна. Когда
эта разность превысит определенное
значение ΔTc
,
которое зависит от свойств жидкости и
толщины слоя, вся среда разбивается на
правильные шестигранные ячейки (рис.
3.1б), в центре каждой из которых жидкость
поднимается вверх, а по краям – вниз.
Центр тяжести элементарной ячейки
жидкости как бы поднимается вверх,
становится неустойчивым и опрокидывается.
Дальнейшее повышение разности температур
ΔТ приводит к разрушению ячеек и
хаотическому (турбулентному) движению
жидкости. Формирование именно шестигранных
ячеек объясняется на основе принципа
минимальной диссипации энергии, т.к.
только в этом случае имеет место
минимальное отношение поверхности к
объему.
Это весьма наглядный пример оптимального
решения, найденного природой (неживой
природой), реализуемого
посредством самоорганизации.
Рис. 3.1. Модель Бенара
