
- •Рівномірний рух
- •Розділи механіки:
- •I закон Ньютона:
- •Література:
- •Розподіл Больцмана.
- •Контрольні питання:
- •Література:
- •П ровідники
- •Контрольні питання:
- •Література:
- •Тема: Електромагнітна індукція. Самоіндукція. Рівняння Максвелла
- •Контрольні питання:
- •Контрольні питання:
- •Контрольні питання:
- •Тема: Електромагнітні коливання. Змінний струм. План:
- •Контрольні питання:
- •Тема: Дифракція хвиль. План:
- •Контрольні питання:
- •Тема: Поляризація світла План:
- •Контрольні питання:
- •Тема: Квантова фізика. Фотоефект. План:
- •Контрольні питання:
- •Тема: Рентгенівське випромінювання. Ефект Комптона. Закономірності випромінювання. План:
- •Контрольні питання:
- •Тема: Корпускулярно- хвильовий дуалізм. План:
- •Контрольні питання:
- •Література:
- •Тема: Атомне ядро План:
- •Контрольні питання:
Література:
І.М. Кучерук, І.Т. Горбачук, П.П. Луцик Загальний курс фізики т.1, р. 7, § 7.1 - 7.
Тема: «Розподіл Больцмана, Максвелла»
План:
Розподіл Больцмана.**
Розподіл Максвелла.**
Довжина вільного пробігу молекул.**
Розподіл Больцмана.
Розглядаємо ідеальний газ в полі
сил тяжіння: стовп газу має висоту
![]() ,
площу
.
,
площу
.
Умови:
![]() ,
,
![]() -
ізотерма атмосфери.
-
ізотерма атмосфери.
Тоді
![]()
Так як
![]()
![]() ;
;
![]() ;
;
![]()
![]() ;
;
![]() ,
тоді
,
тоді
![]() ;
;
![]()
![]() ,
якщо
,
якщо
![]() ,
то
,
то
![]()
Розподіл атмосферного тиску по висоті:
![]() ,
так як
,
так як
![]() ,
,
![]() ,
то
,
то
![]() -
розподіл концентрації по висоті.
-
розподіл концентрації по висоті.
![]() .
Аналіз отриманої формули:
.
Аналіз отриманої формули:
![]() ,
,
![]()



dh




 h
h
2 .Розподіл Максвелла.
Розглядаємо ідеальний газ, що складається
з
![]() молекул і знаходиться в стані рівноваги.
молекул і знаходиться в стані рівноваги.
![]() ;
;
![]()
![]() -
ймовірність того, що молекула має
швидкість в інтервалі від
до
-
ймовірність того, що молекула має
швидкість в інтервалі від
до
![]() .
.
![]() -
формула розподілу ймовірності.
-
формула розподілу ймовірності.
За умовою нормування
![]() можна знайти
можна знайти
![]()
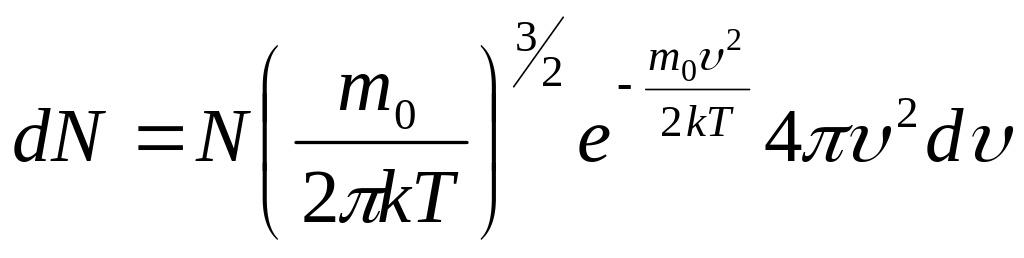 -
число молекул, що мають швидкість в
інтервалі від
до
.
-
число молекул, що мають швидкість в
інтервалі від
до
.
![]()

![]()
T 2
2
 T1
T1


 T3
T3




dv V
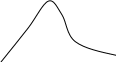
Розглядаючи криву розподілу швидкостей молекул, можна виділити такі особливості :
1. крива розподілу швидкостей проходить через початок координат ( не має молекул , що не рухаються).
2. крива має мах ,після якого асимптотично наближається до осі абсцис. Значить великі швидкості малоймовірні, так як великі швидкості можливі лише тоді, коли молекула в результаті зіткнення отримує енергію і не віддає її.
3. крива розподілу швидкостей не симетрична.
4. Т3>T1- з підвищенням температури криза розподілу молекул стає більш пологою.
Для характеристики швидкостей руху молекул газу використовують три поняття середньої швидкості:
1. середня квадратична швидкість
![]()
2. середня арифметична швидкість
![]()
3. найбільш ймовірна швидкість

Закон розподілу швидкостей молекул ( закон Максвелла) справедливий лише для газів.
2а. Експериментальна перевірка закону розподілу Максвелла (дослід Штерна).





 Подовж осі коаксіальних
циліндрів (r i
R) натягнута платинова
дротина, вкрита шаром срібла, яка
нагрівається електричним струмом.
Срібло випаровується і молекули газу
рухаються по всім радіальним напрямам.
У внутрішньому циліндрі є отвір. Щоб
атоми срібла не гальмувалися молекули
повітря, всередині посудини створений
вакуум
Подовж осі коаксіальних
циліндрів (r i
R) натягнута платинова
дротина, вкрита шаром срібла, яка
нагрівається електричним струмом.
Срібло випаровується і молекули газу
рухаються по всім радіальним напрямам.
У внутрішньому циліндрі є отвір. Щоб
атоми срібла не гальмувалися молекули
повітря, всередині посудини створений
вакуум
![]() Па.
Якщо циліндри нерухомі, то на зовнішньому
спостерігаються плями, що є відображенням
отвору. Якщо обидва циліндра обертаються
з однаковою швидкістю, то срібна пляма
на зовнішньому циліндрі зміщуються на
S. При цьому товщина плями
в різних місцях різна.
Па.
Якщо циліндри нерухомі, то на зовнішньому
спостерігаються плями, що є відображенням
отвору. Якщо обидва циліндра обертаються
з однаковою швидкістю, то срібна пляма
на зовнішньому циліндрі зміщуються на
S. При цьому товщина плями
в різних місцях різна.

Аналогічні досліди були проведені декілька десятків разів. В результаті було встановлено, що зі збільшенням сили струму зростає температура і пляма зміщується, що можна пояснити скориставшись законом розподілу молекул за швидкостями Максвелла.
3. Довжина вільного пробігу молекул
Число зіткнень молекул:
![]() ;
;
![]()
![]()
 ;
;
![]()

Контрольні питання:
1. Виведіть барометричну формулу.
2. Зобразіть криву розподілу молекул газу за швидкостями.
3.Якими швидкостями характеризують рух молекул?
4. Від чого залежить довжина вільного пробігу молекул?
5. Чому дорівнює середня квадратична швидкість молекул повітря при температурі 33 К?
6. Розрахуйте концентрацію молекул повітря на висоті, що дорівнює радіусу Землі.
Література:
І.М. Кучерук, І.Т. Горбачук, П.П. Луцик Загальний курс фізики т.1, р.14,§ 9-13.
Тема: Основне рівняння МКТ ідеального газу. Термодинамічна рівновага.
Температура - параметр рівноваги. Газові закони.
План:
1. Основне рівняння МКТ ідеального газу.**
2. Температура – параметр рівноваги.*
3. Рівняння стану ідеального газу.*
4. Газові закони**
1. В кінці 18ст. Д. Бернуллі встановив зв'язок між макропараметром, що характеризує систему (Р) і мікропараметрами - основне рівняння МКТ ІГ.








C D
![]()
x
V
A F
А К
Всередині паралелепіпеда знаходиться ІГ. Розрахуємо тиск газу на праву грань подовж осі Х
![]() -
сила дії молекул на стінку ;
-
сила дії молекул на стінку ;
![]() -
сила дії стінки на молекулу
-
сила дії стінки на молекулу
Нехай взаємодія відбувається , тоді
![]() (наслідок
2-го закону Ньютона)
(наслідок
2-го закону Ньютона)
Так як удар пружній, то
![]()
В проекціях на вісь х маємо:

Z- число молекул, що за
підійдуть до стінки. Виділимо в
паралелограмі об’єм ABCDEFK
в якому всі молекули встигають підійти
до стінки. Куб має ребро L.
Допустимо, що всі молекули мають однакову
швидкість, припустимо що
![]() рухається вправо, тоді
рухається вправо, тоді

Розрахунок тиску
![]() -
основне рівняння МКТ ІГ.
-
основне рівняння МКТ ІГ.
Так як всі напрямки рівноправні, то тиск однаковий на всіх напрямах (закон Паска ля)

Висновок :
Основне рівняння МКТ ІГ – це рівняння, що зв’язує макропараметр з мікропараметрами.
Тиск ІГ визначається через середні величини, що характеризують систему як єдине ціле.
Так як тиск визначають як середній результат взаємодії, то ставити питання про тиск однієї молекули безпідставно.
Тиск газу по всім напрямам однаковий (закон Паскаля).
2. Поняття про температуру. Теплова (термодинамічна) рівновага.
За допомогою тиску не можна отримати повного опису різних станів газу (холодний, гарячий газ). Значить, необхідно вияснити з позиції МКТ, що значить температура газу.
Температурою користуються для опису тільки рівновісних станів, процесів.




![]()
![]()
![]()
![]()
Через шар молекули в посудині обмінюються енергією з молекулами зовні.
Якщо
![]() -
система нагрівається
-
система нагрівається
![]() -
система охолоджується
-
система охолоджується
![]() -
стан рівноваги ( термодинамічна)
-
стан рівноваги ( термодинамічна)
Теплова рівновага – це процес, в якому настає рівність в обміні енергією
між системою частинок і їх оточенням.
Температура – фізична величина, використовується для опису теплової рівноваги між системою частинок і їх оточенням.
В стані теплової рівноваги температура тіла (системи частинок) і його оточення рівні.
Статистична температура є мірою середньої кінетичної енергії молекул газу. Так як
кінетична енергія не може бути від’ємною,
![]() -
найнижча температура.
-
найнижча температура.
Термодинамічна температура призначена для заміни незручних величин статистичної температури більш зручними числами з точки зору повсякденно життя.

k- постійна Больцмана


Температуру вимірюють термометром. Бувають газові, рідинні, електричні, тощо.
3. Рівняння стану ІГ
Рівняння, що зв’язує макропараметри термосистеми називається рівнянням стану ІГ.

 3а.
Об’єднаний газовий закон ( закон
Клапейрона) .
3а.
Об’єднаний газовий закон ( закон
Клапейрона) .
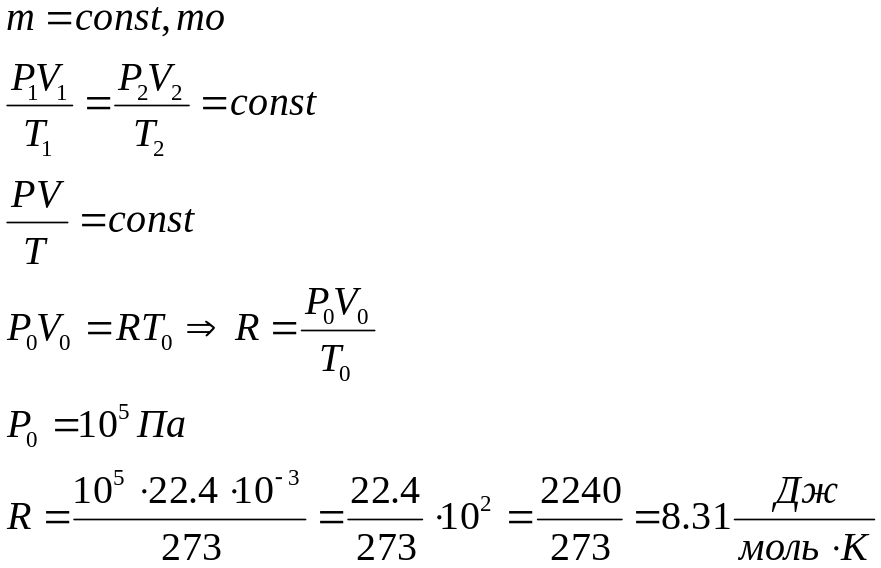
Фізичний зміст R: показує
відношення
![]() до
до
![]() для 1 моля, що знаходиться за нормальних
умов.
для 1 моля, що знаходиться за нормальних
умов.
4. Ізопроцеси
Процеси, що протікають при постійному значенні одного з макропараметрів, називаються ізопроцесами.
Ізопроцеси бувають:
 (ізотермічний)
(ізотермічний) (ізобарний)
(ізобарний) (
ізохорний)
(
ізохорний)
4а. Ізотермічний процес- це процес, що протікає при постійній температурі газу.

Закон Бойля-Маріотта.: Для даної маси ІГ добуток тиску газу на його об’єм при сталій температурі залишається постійним.
PV=const



 ізотерма P
ізотерма P
ізотерма
![]()

![]()
![]()

 T
T
T
T
V
V




 T3
T3
T2 T3>T2>T1
T1

![]() T
T
4б. Ізобарний процес – це
процес, що протікає при постійному тиску
(P=const).
![]()
Закон Гей-Люссака: Об’єм даної маси ІГ при сталому тиску прямо пропорційний його абсолютній температурі.
V P P
P P


2
V2 ізобара

 V2 T2
V2 T2
1 V1 T1
V1
 T T T V
T T T V
P1>P2 V2<V1
T2>T1
![]() температурний
коефіцієнт об’ємного розширення
температурний
коефіцієнт об’ємного розширення
Відносна зміна об’єму при зміні
температури на 1 К
![]()
![]() закон Гей – Люссака.
закон Гей – Люссака.
Для більшості газів, що знаходяться
за нормальних умов, температурний
коефіцієнт об’ємного розширення не
залежить від природи газу і дорівнює
![]()
4в. Ізохорний процес -це процес, що протікає при сталому об’ємі газу.
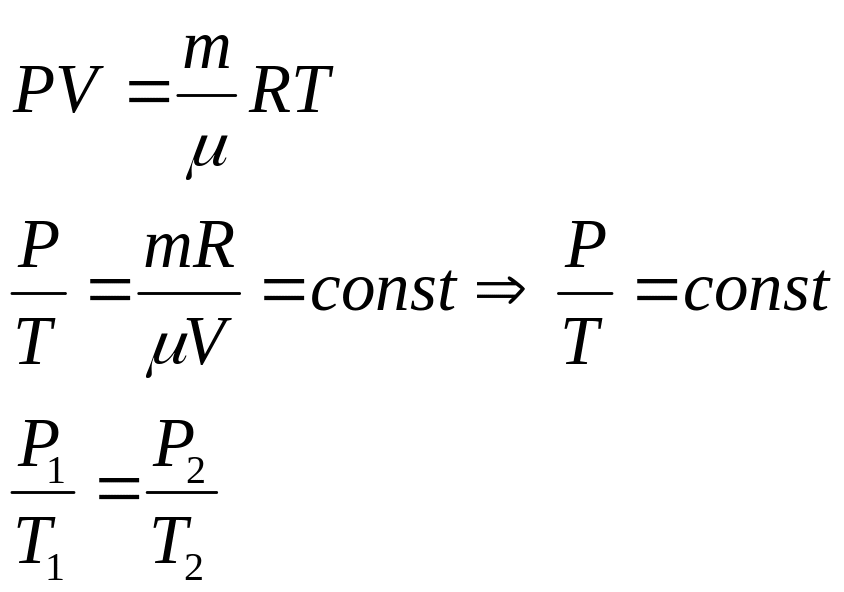
Закон Шарля: Тиск даної маси газу прямо пропорційний температурі, якщо об’єм газу залишається сталим.
P V P 1 2




2 2

 1
1
ізохора 1
 T
Т V
T
Т V
V2<V1 P2<P1 T2>T1
Для нормальних умов
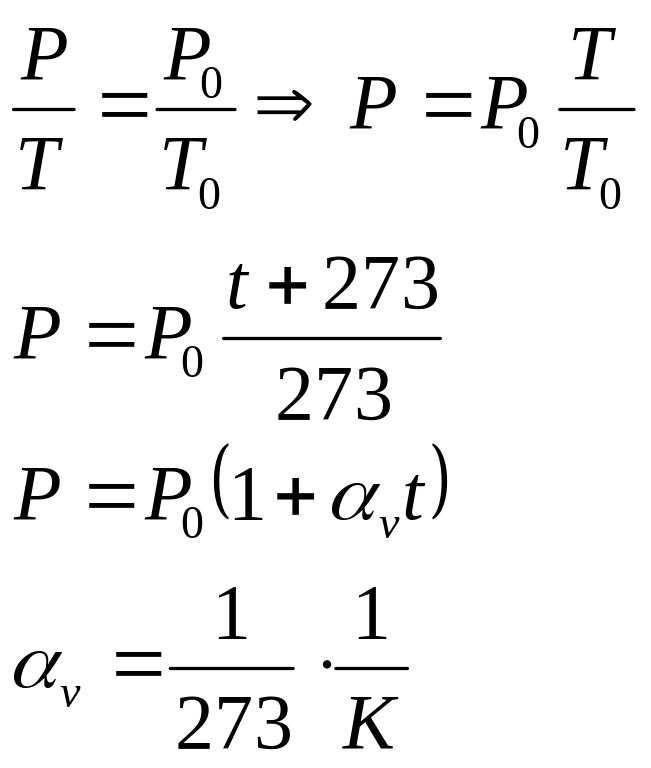
Закон Шарля: Для більшості газів, що
знаходяться при нормальних умовах,
температурний коефіцієнт тиску не
залежить від природи газу і дорівнює
![]() .
.

Для нормальних умов
![]()
Якщо v=1моль,
Закон Авогадро. Один моль будь-якого газу за нормальних умов займає об’єм 22,4л
Парціальний тиск – це тиск, що створює одна компонента суміші при відсутності інша.
![]()
Для суміші газів

Закон Дальтона. Тиск суміші газів дорівнює сумі його парціальних тисків.
