
Тестовые задания по неорганической химии I типа.
Инструкция: из предложенных пяти вариантов ответов выбрать один правильный ответ.
1. Все периоды (кроме первого) начинаются:
1. неметаллом;
2. водородом;
3. щелочным металлом;
4. инертным газом;
5. щелочноземельным металлом.
2. В ряду Zi – Na – K – Rb – Cs – Fr металлические свойства:
1. увеличиваются;
2. ослабевают;
3. не увеличиваются;
4. уменьшаются;
5. остаются без изменений.
3. Все элементы побочных подгрупп являются:
1. металлами;
2. неметаллами;
3. инертными газами;
4. металлами и неметаллами;
5. галогенами.
4. Квантовое число, характеризующее размер электронного облака:
1. магнитное;
2. спиновое;
3. главное;
4. орбитальное;
5. побочное.
5. Максимальное число электронов на энергетическом уровне определяется по формуле:
1. n2;
2. 2 l + 1;
3. 2n2;
4. 2(2 l + 1);
5. 2 l.
6. Подуровень, для которого n=3, l=1 обозначается:
1. 3s;
2. 3p;
3. 4s;
4. 3d;
5. 3f.
7. К s-элементам относится элемент:
1. Sc;
2. Mg;
3. Sn;
4. As;
5. Mn.
8. Орбитальное квантовое число для третьего энергетического уровня принимает значения:
1. 0, 1;
2. 1, 2;
3. 1, 2, 3;
4. 0, 1, 2;
5. 0, 1, 2, 3.
9. Атомы изотопов одного элемента отличаются:
1. числом протонов;
2. числом нейтронов;
3. числом электронов;
4. числом протонов и нейтронов;
5. зарядом ядра.
10. Атому железа соответствует электронная конфигурация:
1. 1s22s22p63s2
2. 1s22s22p63s23p64s1
3. 1s22s22p63s23p64s23d6
4. 1s22s22p63s23p64s2
5. 1s22s22p63s23p4
11. Между молекулами воды образуется связь:
1. металлическая;
2. ионная;
3. ковалентная полярная;
4. водородная;
5. ковалентная неполярная.
12. Летучие водородные соединения элементов VI группы периодической системы
имеют общую формулу:
RH3
RH4
RH5
H2R
HR
13. Самый активный металл в любом периоде находится:
1. в начале периода;
2. в конце периода;
3. ближе к началу периода;
4. в середине периода;
5. ближе к концу периода.
14. Химических элементов V периоде:
1. 18;
2. 32;
3. 8;
4. 12;
5. 20.
15. Число энергетических ячеек на уровне определяется по формуле:
1. 2 n2;
2. 2 l + 1;
3. n2;
4. 2 (2 l +1);
5. 4 n.
16. Направление электронных облаков в пространстве характеризует:
1. главное квантовое число;
2. орбитальное квантовое число;
3. магнитное квантовое число;
4. спиновое квантовое число;
5. побочное квантовое число.
17. Подуровень, для которого n=5, l=2 обозначается:
1. 5s;
2. 5d;
3. 5f;
4. 5p;
5. 4d.
18. Числовое и буквенное обозначение главного квантового числа:
1. S P D F
0 1 2 3
2. K L M O P Q
1 2 3 4 5 6
3. K L M N O P Q
1 2 3 4 5 6 7
4. O P Q Z
1 2 3 4
5. K L M
1 2 3
19. К p–элементам относится:
1. Be;
2. Si;
3. Na;
4. He;
5. K.
20. Электронные облака p-подуровня имеют форму:
1. шара;
2. гантели;
3. розетки;
4. сложной розетки;
5. очень сложную форму.
21. Среди приведенных электронных конфигураций укажите невозможную:
1. 1s3
2. 2p6
3. 3p5
4. 4p6
5. 4d10
22. Ковалентная неполярная связь образуется в веществе:
1. NaBr;
2. CaO;
3. Cl2;
4. HCl;
5. SO3 .
23. В побочную подгруппу I группы входит элемент:
1. Na;
2. K;
3. Cu;
4. Cs;
5. Rb.
24. В шестом периоде элементов:
1. два;
2. восемнадцать;
3. восемь;
4. тридцать два;
5. двадцать шесть.
25. Максимальное число электронов на подуровне определяют по формуле:
1. 2 (2 l +1);
2. 2 l - 1;
3. n2;
4. 2 n2;
5. n + 1.
26. Число протонов в атоме элемента со строением валентных подуровней …3d64s2 равно:
1. 8;
2. 30;
3. 32;
4. 26;
5. 31.
27. Подуровень, для которого n=2, l=0 обозначается:
1. 2s;
2. 2p;
3. 2d;
4. 2f;
5. 3s.
28. Для второго энергетического уровня значения орбитального квантового числа равны:
1. 0;
2. 0, 1;
3. 0, 1, 2;
4. 0, 1, 2, 3;
5. 0, 1, 2, 3, 4.
29. К d–элементам относится атом:
1. Mg;
2. B;
3. Ca;
4. Mn;
5. Cl.
30. Электронная конфигурация 1s22s22p63s23p64s23d3 соответствует:
1. Mn;
2. V;
3. Sc;
4. Cl;
5. Cu.
31. Спиновое квантовое число показывает:
1. число ячеек на подуровне;
2. величину запаса энергии на уровне;
3. вращение электрона вокруг своей оси;
4. удаленность электрона от ядра;
5. величину запаса энергии на подуровне.
32. Вещества, имеющие ковалентную полярную связь, расположены в ряду:
1. O2, NH3, H2;
2. HBr, SO3, HCl;
3. HF, H2O, P;
4. H2SO4, Na, NaCl;
5. HCl, H2, Cl2.
33. В периодической системе групп:
1. 7;
2. 8;
3. 6;
4. 9;
5. 10.
34. Характер оксидов в ряду Na2O, MgO, Al2O3, SiO2, P2O5 изменяется:
1. от основного к кислотному;
2. от кислотного к основному;
3. от основного к амфотерному;
4. от амфотерного к основному;
5. от амфотерного к кислотному.
35. Высший оксид элемента с порядковым номером 25 имеет формулу:
1. R2O5
2. RO3
3. R2O7
4. RO4
5. R2O3
36. Число энергетических ячеек на подуровне определяется по формуле:
1. 2 l + 1;
2. 2 (2 l +1);
3. n2;
4. 2 n2;
5. 2 l + 0.
37. Электронная конфигурация …4s23d5 отвечает основному состоянию атома:
1. калия;
2. ванадия;
3. скандия;
4. марганца;
5. меди.
38. Подуровень, для которого n=4, l=3 обозначается:
1. 4s;
2. 4f;
3. 4d;
4. 4p;
5. 5s.
39. К d–элементам относится:
1. B;
2. Al;
3. Ca;
4. Cu;
5. As.
40. Побочное квантовое число для IV энергетического уровня принимает значения:
1. 0, 1, 2, 3;
2. 0, 1;
3. 0, 1, 2;
4. 0, 1, 2, 3, 4;
5. 1, 2, 3.
41. Протон характеризуется:
1. масса приближается к нулю, заряд = -1;
2. масса ~ 1, заряд = -1;
3. масса ~ 1, заряд = +1;
4. масса = 1, заряд = 0;
5. масса меньше 1, заряд = -1.
42. На d-орбитали для основного состояния атома возможна схема:
-
1
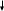 .
.2 .
3 .
4 .
5 .
43. Прочность связи водород – галоген в ряду молекул HF – HCl – HBr – HI:
1. постепенно уменьшается;
2. практически не изменяется;
3. не уменьшается;
4. увеличивается;
5. сначала уменьшается, потом увеличивается.
44. В периодической системе рядов:
1. 7;
2. 8;
3. 9;
4. 10;
5. 12.
45. Элемент, находящийся в пятом периоде, II группе, главной подгруппе,
имеет порядковый номер:
37;
48;
30;
46;
38.
46. Последний элемент в каждом периоде (за исключением седьмого периода) относится к:
1. галогенам;
2. щелочным металлам;
3. актиноидам;
4. инертным газам;
5. щелочноземельным металлам.
47. В атоме скандия порядок заполнения энергетических подуровней:
1. …4s4p
2. …4d4s
3. …4s3p
4. …4s3d
5. …4p3d
48. Наибольшее число неспаренных электронов в основном состоянии содержит атом:
1. азота;
2. хрома;
3. меди;
4. хлора;
5. лития.
49. Атомное ядро состоит из:
1. протонов и электронов;
2. протонов;
3. нейтронов и протонов;
4. электронов и нейтронов;
5. нейтронов.
50. Металлическую связь образует элемент с электронной конфигурацией атома:
1.1s1
2. 1s2
3. …2s22p4
4. …2s22p6
5. …3s23p64s13d5
51. В периодической системе периодов:
1. 8;
2. 5;
3. 7;
4. 10;
5. 6.
52. Общая формула высшего оксида всех элементов IV группы:
1. RO
2. RO4
3. R2O5
4. RO2
5. R2O3
53. Сокращенная электронная конфигурация …4s23d1 отвечает основному состоянию атома:
1. калия;
2. кальция;
3. скандия;
4. меди;
5. алюминия.
54. Энергетических ячеек на f подуровне:
1. 1;
2. 3;
3. 7;
4. 5;
5. 6.
55. Для основного состояния атома на р-орбиталях возможна схема
распределения электронов:
-
1 .
2 .
3 .
4 .
5 .
56. Символы только d–элементов расположены в ряду:
1. Ca, Mn, Co;
2. S, Cl, Sc;
3. Sc, Ag, Ca;
4. V, Fe, Ni;
5. Cu, As, Br.
57. Величина, характеризующая электрон:
1. масса = 1, заряд = 0;
2. масса = 1, заряд = +1;
3. масса = 1, заряд = -1;
4.масса = 0,01, заряд = +1;
5. масса приближается к нулю, заряд = -1.
58. Невозможна конфигурация:
3f10
1s2
2p3
3d5
4s2
59. В ионе аммония по донорно-акцепторному механизму образованы химические связи:
1. две связи образованы по донорно-акцепторному механизму;
2. одна из связей N-H образована по донорно-акцепторному механизму;
3. все связи – ковалентные, образованные по обменному механизму;
4. три связи образованы по донорно-акцепторному механизму;
5. все связи – ионные.
60. Основным является оксид:
5. CO2. |
|
61. При прокаливании какого вещества образуется основный оксид:
|
|
Элементом, образующим кислотный, основный и амфотерный оксид, является:
Сr;
Cu;
S;
N;
K.
Оксид кальция взаимодействует с:
CO2;
2. K2O;
3. NaOH;
4. CuO;
5. NaCl.
Непосредственным растворением в воде соответствующего оксида можно получить основание:
|
|
65. Пара веществ, не реагирующих между собой, это:
азотная кислота и гидроксид бария;
хлорид магния и гидроксид лития;
сульфат натрия и хлорид бария;
вода и оксид меди (II);
сульфид натрия нитрат свинца (II).
66. Двухосновной является кислота:
1. ортрофосфорная; 2. пирофосфорная; 3. иодофосфорная; 4. тиосерная; 5. азотная. |
|
Оксиду серы (IV) соответствует кислота:
1. Н2SO4; 2. H2S2O3; 3. H2S; 4. H2SO3; 5. H2S2O7. |
|
68. Металл, не реагирующий с азотной кислотой:
Zn;
Mg;
Au;
Al;
Ni.
Лакмус в растворе NaOH:
красный;
синий;
фиолетовый;
бесцветный;
зеленый.
70. Название «дигидроксосульфат железа (III) соответствует соли:
1. [Fe(OH)2]2SO3; 2. FeOHSO4; 3. [Fe(OH)2]2SO4; 4. FeOHS; 5. [Fe(OH)2]2S. |
|
|
Раствор хлорида меди (II) взаимодействует с металлом:
Zn;
Hg;
Ag;
Au;
Pt.
72. С водой не взаимодействует оксид:
1.K2O;
2. SO3;
3. SiO2;
4. BaO;
5. CO2.
73. Кислотными оксидами являются оксиды ряда:
1. CO2, SO2, CaO; 2. Mn2O7, CrO3, SO3; 3. Ag2O, P2O5, SnO2; 4. CO, SO2, P2O3; 5. CuO, Al2O3, N2O5. |
|
74. Название какого оксида составлено неправильно:
1. MgO – оксид магния;
2. Cl2O7 – оксид хлора (VII);
3. HgO – оксид ртути (II);
4. MnO2 – оксид марганца;
5. Ag2O –оксид серебра (I).
75. Реакция получения оксида серы (VI):
1. SO2 + O2
2. S + O2
3. S + H2O
4. H2SO3
5. S + H2SO4 (конц.)
76. С КОН взаимодействуют:
оксид бария;
гидроксид цинка;
оксид магния;
хлорид калия;
сульфат бария.
77. В растворе щелочей лакмус имеет цвет:
красный;
малиновый;
синий;
желтый;
фиолетовый.
78. Оксиду хлора (VII) соответствует кислота:
HCl;
HClO;
HClO2;
HClO3;
HClO4.
79. Трехосновной кислотой является:
бромоводородная;
угольная;
серная;
мышьяковая;
5. сероводородная.
80. С разбавленной серной кислотой взаимодействуют оба вещества:
Mg(OH)2, BaCl2
Al(OH)3, CO2
CuSO4, NO
Mg, SiO2
5. Hg, CuO
81. Металл, реагирующий с нитратом свинца (II):
Cu;
Zn;
Ag;
Hg;
Au.
82. Соль образуется при взаимодействии веществ:
Cu(OH)2 + HCl
Fe + O2
Hg + HCl
C + O2
5. CaCO3
83.Осадок образуется при взаимодействии:
|
|
84. Трехосновной кислотой является:
|
|
85. Оксид серы (IV) взаимодействует с:
|
|
86. Все оксиды реагируют с водой в ряду:
|
|
87. Реакция нейтрализации протекает при взаимодействии веществ:
|
|
88. Гидроксид железа (III) можно получить при взаимодействии веществ:
|
|
89. Однокислотным является основание:
|
|
90. При растворении в воде кислоту образует вещество:
|
|
91. С азотной кислотой взаимодействуют все вещества в ряду:
|
|
92. При взаимодействии разбавленной серной кислоты с цинком выделяется газ:
|
|
93. Кислые соли может образовывать кислота:
азотная;
угольная;
азотистая;
хлористая.
94. Силикат калия - это:
оксид;
кислая соль;
основная соль;
основание;
нормальная (средняя) соль.
95. С серной кислотой взаимодействуют оксиды ряда:
5. Fe2O3, MgO, P2O3. |
96. Соли тиосерной кислоты называются:
сульфаты;
тиосульфаты;
сульфиды;
сульфиты;
полисульфиды.
97. С КОН взаимодействуют вещества ряда:
5. Al2O3, N2O5, N2O3. |
98. При взаимодействии оксида с водой можно получить основание:
|
|
99. Хлороводородная кислота реагирует с:
|
|
100. К числу амфотерных оксидов относятся все три оксида:
|
|
101. Не могут реагировать соединения:
|
|
102. Разбавленная серная кислота не будет реагировать с металлом:
Hg;
Mg;
Zn;
Al;
Fe.
103. Основным оксидом является:
|
|
104. Оксид цинка взаимодействует с веществом:
|
|
105. Получается один кислотный и один основный оксид при разложении вещества:
|
|
106. Нерастворимым основанием является:
|
|
107. Реакцией нейтрализации является:
|
|
108. Между собой не реагируют вещества:
|
|
109. Соляная кислота реагирует с солью:
|
|
110. С разбавленной серной кислотой не взаимодействует металл:
Zn;
Fe;
Ni;
Hg;
Al.
111. Реакция является необратимой при взаимодействии солей:
|
|
112. Соли бромной кислоты называются:
бромиды;
броматы;
бромиты;
перброматы;
гипобромиты.
113. Несолеобразующим является оксид:
|
|
114. Гидроксид цинка проявляет кислотные свойства, реагируя с:
соляной кислотой;
хлоридом натрия;
гидроксидом натрия;
водой;
серной кислотой.
115. Щелочью является:
|
|
116. Трехкислотным основанием является:
|
|
117. Гидроксид калия взаимодействует с:
|
|
118. В одной пробирке находится раствор хлорида магния,
в другой – хлорид алюминия. С помощью какого одного реактива можно
различить растворы этих солей?
|
|
119. В серной кислоте степень окисления серы:
+2;
-2;
+4;
+6;
+5.
120. При взаимодействии разбавленной серной кислоты с цинком выделяется газ:
|
|
121. С соляной кислотой реагируют все вещества, находящиеся в ряду:
|
|
122. Название «дигидроксосульфит железа (III)» соответствует соли:
|
|
123. Комплексообразователем в соединении [Cr(NH3)4CO3]Cl является:
|
|
124. В соединении [Ag(NH3)4CO3]Cl величина и знак комплексного иона равны:
|
|
125. При диссоциации одной молекулы комплексной соли K3[Co(NO2)6] протекающей по I ступени образуется ионов:
3;
4;
6;
5;
8.
126. В соединении [Cu(NH3)4]SO4 величина и знак комплексного иона равен:
4-;
2-;
2+;
3-;
3+.
127. При диссоциации двух молекул комплексной соли [Cr(H2O)4Cl2]Cl , протекающей по I ступени образуется ионов:
2;
6;
4;
3;
8.
128. Максимальное координационное число 6 имеет комплексообразователь:
|
|
129. В ионе [Ag(S2O3)2]3- величина и знак заряда комплексообразователя равны:
2+;
1+;
3+;
4+;
5+.
130. Координационное число 6 имеет комплексообразователь:
|
|
131. Комплексный ион является катионом в соеднении:
5. Zn3K2[Fe(CN)6]. |
132. При диссоциации комплексного соединения CaKNH4[Fe(CN)6] по I ступени образуется ионов:
3;
2;
4;
6;
8.
133. В соединении [Ni(NH3)5Cl]NO3 комплексообразователем является:
|
|
134. Названию комплексного соединения «сульфат бромопентааммин кобальта (III)» соответствует формула:
|
|
135. Степень окисления иона комплексообразователя в комплексном ионе [Ni(NH3)5Cl]+ равна:
2 +;
3 -;
1 +;
4 +;
5 -.
136. При диссоциации комплексного соединения K[Au(CN)2] по первой ступени образуется ионов:
4;
3;
2;
5;
1.
137. В комплексном соединении K3[Fe(CN)6] координационным числом является число:
1;
2;
4;
6;
3.
138. В комплексном соединении K[Au(CN)2] величина и знак комплексного иона равна:
1+;
1-;
2+;
2-;
3+.
139. Электролитом, образующим при диссоциации ионы водорода, является:
1. нитрат бария;
2. гидроксид аммония;
3. сернистая кислота;
4. хлорид кальция;
5. гидроксид натрия.
140. Катионом является ион:
1. Cl-;
2. Mg 2+;
3. ClO4-;
4. Br-;
5. S2-
141. При диссоциации двух молекул Cr2(SO4)3 образуется ионов:
1. 5;
2. 10;
3. 12;
4. 4;
5. 8.
142. Сокращенное ионное уравнение CO32- + 2H+ = H2O + CO2 отвечает взаимодействию:
1. BaCO3 c HNO3;
2. Na2CO3 c H2SO4;
3. CaCO3 c HCl;
4. Ca(OH)2 c CO2;
5. CaCO3 c CO2 и H2O.
143. В виде ионов в ионном уравнении реакции записываются:
1. оксиды;
2. нерастворимые соли;
3. щелочи;
4. газы;
5. нерастворимые основания.
144. Не подвергается гидролизу соль:
1. CrCl3;
2. KH2PO4;
3. Al2S3;
4. K2SO4;
5. Na2CO3 .
145. Окраска фенолфталеина изменяется в растворе соли:
1. CsCl;
2. BaBr2;
3. Ba(NO3)2;
4. K2CO3;
5. BiCl3.
146. В 150г 5% раствора растворенного вещества содержится:
1. 15г;
2. 5г;
3. 10г;
4. 20г;
5. 7,5г.
147. Для приготовления 2% раствора соли массой 150г нужно взять:
1. 20г соли и 130г воды;
2. 3г соли и 147г воды;
3. 10г соли и 140г воды;
4. 30г соли и 120г воды;
5. 15г соли и 135г воды.
148. Количество растворенного вещества в одном литре децимолярного раствора равно:
1. 0,01 моль;
2. 0,1 моль;
3. 1 моль;
4. 10 моль;
5. 0,5 моль.
149. Электролитом, образующим при диссоциации гидроксид-ион является:
1. серная кислота;
2. гидроксид натрия;
3. нитрат висмута;
4. оксид кальция;
5. борная кислота.
150. Анионом является ион:
1. Fe2+;
2. PO43-;
3. Mg2+;
4. Co3+;
5. Hg2+. 151. При диссоциации одной молекулы KCr(SO4)2 образуется ионов:
1. 6;
2. 5;
3. 4;
4. 2;
5. 3.
152. В 2л одномолярного раствора растворенного вещества содержится:
1. 0,1 моль;
2. 0,01 моль;
3. 0,2 моль;
4. 0,4 моль;
5. 2,0 моль.
153. Сокращенное ионное уравнение Ag+ + Cl- = AgCl отвечает взаимодействию:
1. AgNO3 c Cl2;
2. AgNO3 c NaCl;
3. AgNO3 c HClO;
4. Ag c HCl;
5. AgNO3 c HClO2.
154. В растворе совместно могут находится ионы:
1. Ca2+ и PO43-;
2. Ag+ и CL-;
3. Ba2+ и SO42-;
4. K+ и SO42-;
5. Mg2+ и PO43-.
155. В результате выделения газа реакция протекает до конца между:
1. Na2CO3 и HCl;
2. CuSO4 и KOH;
3. FeCl3 и NaOH;
4. BaCl2 и H2SO4;
5. Fe(OH)2 и HCl.
156. Метилоранж окрашивается в красный цвет при значении рН:
1. 10;
2. 3;
3. 7;
4. 9;
5. 12.
157. Гидролизу не подвергается соль:
1. CH3COONa;
2. CuSO4;
3. NH4Cl;
4. Ba(NO3)2;
5. Na2S .
158. Лакмус имеет синий цвет в растворе соли:
1. K2S;
2. FeCl3;
3. Al2S3;
4. K2SO4;
5. MgCl2.
159. При растворении сахара массой 50г в воде массой 200г образуется раствор
с массовой долей сахара:
1. 30%;
2. 10%;
3. 20%;
4. 25%;
5. 40%.
160. Электролитом, образующим при диссоциации ионы водорода и гидроксид-ионы одновременно, является:
Ca(OH)2;
Fe(OH)2;
Pb(OH)2;
H3BO3;
NH4OH.
161. При диссоциации трех молекул Fe(NO3)3 образуется ионов:
1. 4;
2. 10;
3. 8;
4. 14;
5. 12.
162. Ионы Ba2+ из водного раствора не осаждает реактив:
1. нитрат лития;
2. карбонат натрия;
3. сульфат натрия;
4. серная кислота;
5. фосфат натрия.
163. Совместно в растворе не могут находиться вещества:
1. хлорид натрия и соляная кислота;
2. нитрат серебра и иодид калия;
3. нитрат калия и фосфат натрия;
4. ацетат натрия и хлорид калия;
5. нитрат бария и вода.
164. Сокращенное ионное уравнение H+ + OH-=H2O отвечает взаимодействию:
1. HCl c Cu(OH)2;
2. HBr c KOH;
3. H2SO4 c Fe(OH)3;
4. HNO3 c Fe(OH)2;
5. H2SiO3 c NaOH.
165. Слабым электролитом является:
1. Ba(NO3)2;
2. NaOH;
3. NH4OH;
4. ZnCl2;
5. MnSO4.
166. Гидроксид натрия количеством вещества 1,5 моль растворили в воде
массой 140г. Массовая доля щелочи в растворе составила:
30%;
20%;
40%;
25%;
15%.
167. Электролитом, образующим при диссоциации ионы водорода, является:
1. сульфид аммония;
2. гидроксид бария;
3. иодид калия;
4. соляная кислота;
5. нитрат натрия.
168. Совместно в растворе не могут находиться ионы:
1. K+ и CH3COO-;
2. Ba2+ и NO3-;
3. NH4+ и SO42-;
4. Ag+ и CrO42-
5. Mg2+ и SO42-.
169. В ионном уравнении реакции 2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O
в виде ионов записываются вещества:
Al(OH)3;
H2SO4 Al2(SO4)3;
H2O;
Al(OH)3 H2SO4;
H2O Al2(SO4)3.
170. Электролит, образующий при диссоциации бромид-ион:
1. AgBr;
2. KBr;
3. KBrO;
4. KBrO2;
5. NaBrO3.
171. Сокращенное ионное уравнение Bа2++SO42-=BaSO4 отвечает взаимодействию:
1. BaCl2 и Na2SO4;
2. BaCO3 и H2SO4;
3. BaCl2 и PbSO4;
4. Ba и H2O;
5. Ba(NO3)2 и Na2S2O3.
172. Количество вещества в одном литре трехмолярного раствора равно:
1. 0,1 моль;
2. 1 моль;
3. 3 моль;
4. 1,5 моль;
5. 2 моль.
173. При диссоциации образует хлорид-ионы электролит:
1. KClO2;
2. KClO;
3. KClO4;
4. NaCl;
5. NaClO3.
174. Сильным электролитом является:
1. NH4OH;
2. H2CO3;
3. HCl;
4. HClO;
5. H2SiO3.
175. Анионом является:
1. Fe3+;
2. MnO4-;
3. Cr3+;
4. Co3+;
5. Au+.
176. В ионном уравнении реакции BaCl2 + K2SO4 = BaSO4 + 2KCl в виде молекулs
записывается вещество:
1. BaSO4;
2. K2SO4;
3. KCl;
4. BaCl2;
5. KCl.
177. Лакмус окрашивается в красный цвет при значении рН:
1. 10;
2. 7;
3. 12;
4. 4;
5. 14.
178. Не подвергается гидролизу соль:
1. K2S;
2. KNO3;
3. BiCl3;
4. Cr2S3;
5. CuSO4.
179. Чтобы подавить гидролиз соли BiCl3 надо добавить:
1. HCl;
2. H2O;
3. NaOH;
4. KOH;
5. KNO3.
180. Значение рН больше 7 при гидролизе соли:
1. MgSO4;
2. Mn(NO3)2;
3. K2S;
4. CrCl3;
5. NaBr.
181. Рассчитать массовую долю растворенного вещества можно по формуле:
1. m=V*p
n
2. c = -----
v
3. m в-ва = m р-ра - m воды
m в-ва
4. w = ------
m р-ра
5. m в-ва = m р-ра + m воды
182. В 2л децимолярного раствора содержится растворенного вещества:
1. 0,2 моль;
2. 1 моль;
3. 0,02 моль;
4. 0,1 моль;
5. 0,4 моль.
183. Ионы Cr3+ при диссоциации образует вещество:
1. K2CrO4;
2. Cr2O3;
3. K2Cr2O7;
4. CrCl3;
5. CrO3.
184. Выпадает осадок при действии на раствор BaCl2 реактива:
1. PbSO4;
2. K2SO4;
3. HNO3;
4. CH3COONa;
5. NaOH.
185. Сокращенное ионное уравнение Ag++ Cl- = AgCl отвечает взаимодействию:
1. AgNO3 c NaClO;
2. Ag2O c H2SO4;
3. AgNO3 c NaCl;
4. AgNO3 c HClO2;
5. AgNO3 c NaClO3.
186. В ионном уравнении реакции CaCl2 + (NH4)2C2O4 = CaC2O4 + 2NH4Cl
записываются в виде молекул соединения:
хлорид кальция;
оксалат кальция;
хлорид аммония;
оксалат аммония;
никакие.
187. Лакмус окрашивается в красный цвет в растворе соли:
1. Al(NO3)3;
2. K2SO3;
3. CH3COONa;
4. (NH4)2CO3
5. NaNO3.
188. Гидролизу подвергается соль:
1. KBr;
2. NaClO4;
3. BaI2;
4. MgSO4;
5. NaCl.
189. Чтобы уменьшить гидролиз хлорида меди (II) надо добавить:
1. H2O;
2. NaOH;
3. HCl;
4. Ba(OH)2;
5. KNO3.
190. Рассчитать молярную концентрацию можно по формуле:
n
1 . c = -----
v
m в-ва
2. w = ------
m р-ра
3. m=V*p
4. m в-ва = m р-ра + m воды
5. m в-ва = m р-ра - m воды
191.Гидролизуется по катиону и аниону соль:
|
|
192. Степень окисления азота одинакова в формулах соединений:
1. HNO3, NH4Cl;
2. NO, HNO2;
3. Ca3N2, N2O3;
4. N2O5, HNO3;
5. NH3, NO2.
193. Схема окислительно-восстановительной реакции, в которой вода является
окислителем:
CaO + H2O
H2O + Cl2
K + H2O
SiO2 + H2O
CO2 + H2O
194. Как называется процесс: S+6 S-2, сколько электронов в нем участвуют:
1. окисление, 2е;
2. восстановление, 8е;
3. окисление, 8е;
4. восстановление, 6е;
5. окисление, 6е.
195. Окислительно-восстановительная реакция:
3S + 6KOH K2SO3 + 3H2O + K2S, является:
межмолекулярной реакцией;
реакцией замещения;
реакцией диспропорционирования;
внутримолекулярной реакцией;
реакцией соединения.
196. Степень окисления +4 кислотообразующие элементы имеют в ионах:
1. NO3-, AsO33-;
2. NO2-, BO33-;
3. HCO3-, SO32-;
4. Cr2O72-, SO42-;
5. PO43-, AsO43-.
197. Схема реакции разложения, сопровождающаяся изменением
степени окисления элементов:
CaCO3 CaO + CO2
Ca(HCO3)2 CaCO3 + CO2 + H2O
KMnO4 K2MnO4 + MnO2 + O2
H2SiO3 SiO2 + H2O
H2SO3 SO2 + H2O
196. Как называется процесс: S-2 S+6 , сколько электронов в нем участвует:
1. окисление, 4е;
2. восстановление, 8е;
3. окисление, 8е;
4. окисление, 10е ;
5. восстановление, 6е.
199. Окислительно-восстановительная реакция 2KClO3 2KCl + 3O2 является:
1. межмолекулярной реакцией;
2. внутримолекулярной реакцией;
3. реакцией обмена;
4. реакцией диспропорционирования;
5. реакцией замещения.
200. Степень окисления элемента фосфора наименьшая в соединении:
1. H3PO4;
2. H3PO3;
3. PH3;
4. H4P2O7;
5. HPO2.
201. В окислительно-восстановительных реакциях только окислительные свойства
проявляет вещество:
йодоводород;
нитрит натрия;
сульфит натрия;
перманганат калия;
пероксид водорода.
202. Как называется процесс: Mn+7 Mn+2 , сколько электронов в нем участвует:
1. восстановление, 5е ;
2. окисление, 5е ;
3. восстановление, 8е;
4. окисление, 7е ;
5. окисление, 10е.
203. Окислительно-восстановительная реакция
Cu + 4HNO3 (конц.) Cu(NO3)2 + 2NO2 + 2H2O является:
1. межмолекулярной реакцией;
2. внутримолекулярной реакцией;
3. реакцией диспропорционирования;
4. реакцией обмена;
5. реакцией нейтрализации.
204. Сумма коэффициентов в правой и левой частях окислительно-восстановительной реакции, протекающей по схеме: Fe(OH)2 + O2 + H2O Fe(OH)3 , равна:
12;
11;
15;
8;
10.
205. Степень окисления +3 у хрома в соединении:
1. K2Cr2O7;
2. K3[Cr(OH)6];
3. CrO3;
4. K2CrO4;
5. CrO.
206. В окислительно-восстановительной реакции: KMnO4+PH3+H2SO4H3PO4+MnSO4+K2SO4+H2O, сумма отданных и принятых электронов равна:
13;
10;
12;
14;
15.
207. Как называется процесс:N+5 N+2, сколько электронов в нем участвует:
1. окисление, 3е ;
2. восстановление, 3е ;
3. восстановление, 5е ;
4. окисление, 8е ;
5. восстановление, 8е .
208. Окислительно-восстановительная реакция 2H2SO4 (конц.) + Cu CuSO4+SO2+2H2O является:
1. внутримолекулярной реакцией;
2. реакцией диспропорционирования;
3. межмолекулярной реакцией;
4. реакцией разложения;
5. реакцией обмена.
209. Сумма коэффициентов в правой и левой частях
окислительно- восстановительной реакции, протекающей по схеме:
NaCrO2 + Br2 + NaOH Na2CrO4 + NaBr + H2O, равна:
25;
20;
30;
24;
28.
210. Степень окисления марганца равна +6:
1. в ионеMnO42-;
2. в молекуле MnO2;
3. в ионе MnO41-;
4. в молекуле Mn2O3;
5. в молекуле MnO.
211. Схема реакции, которая одновременно является ОВР и реакцией соединения:
1. K2O + N2O5 KNO3
2. KNO3 KNO2 + O2
3. Cu + FeSO4 Fe + CuSO4
4. H2 + O2 H2O
5. CaO + H2O Ca(OH)2
212. Как называется процесс:Cl+5 Cl- , сколько электронов в нем участвует:
1. восстановление, 4е ;
2. окисление, 6е;
3. окисление, 4е;
4. восстановление, 6е ;
5. восстановление, 5е .
213. Окислительно-восстановительная реакция Cl2 + H2O HClO + HCl
является:
1. реакцией нейтрализации;
2. межмолекулярной реакцией;
3. реакцией разложения;
4. реакцией диспропорционирования;
5. внутримолекулярной реакцией.
214. Сумма коэффициентов в правой и левой частях
окислительно- восстановительной реакции, протекающей по схеме:
Fe + HNO3 Fe (NO3)3 + NO + H2O, равна:
9;
12;
10;
8;
6.
215. Степень окисления +4 элемента серы в соединении:
1. K2SO4;
2. Na2S;
3. Na2S2O3;
4. Na2SO3;
5. (NH4)2S2O8 .
216. Двойственные окислительно-восстановительные свойства проявляет соединение:
1. азотная кислота;
2. оксид серы (VI);
3. алюминий;
4. оксид азота (V);
5. оксид серы (IV).
2 17.
Химическое равновесие в системе 2NO
+ O2
2NO2
+ Q
при повышении температуры смещается:
17.
Химическое равновесие в системе 2NO
+ O2
2NO2
+ Q
при повышении температуры смещается:
в сторону продуктов реакции;
в сторону исходных веществ;
не смещается;
в левую сторону, а затем в правую;
в правую сторону, а затем в левую.
218. При повышении на каждые 100 С скорость реакции:
1. увеличивается в 2-4 раза;
2. уменьшается в 2-4 раза;
3. не изменяется;
4. незначительно уменьшается;
5. резко уменьшается.
219. Обратимой является реакция:
1. H2O + CO2
2. Zn + H2SO4
3. BaCl2 + H2SO4
4. NaOH + HCl
5. Na2CO3 + HCl
220. При увеличении площади поверхности соприкосновения реагирующих веществ скорость
гетерогенных химических реакций:
уменьшается;
увеличивается;
не изменяется;
незначительно уменьшается;
резко уменьшается.
221. При повышении концентрации реагирующих веществ скорость химической реакции:
1. не изменяется;
2. уменьшается;
3. увеличивается;
4. незначительно уменьшается;
5. резко уменьшается.
222. Реакцией соединения является реакция взаимодействия:
1. цинка с соляной кислотой;
2. оксида цинка с соляной кислотой;
3. гидроксида цинка с соляной кислотой;
4. цинка с гидроксидом натрия;
5. цинка с кислородом.
223. Реакцией обмена является реакция реакция:
1. кальция с кислородом;
2. натрия с водой;
3. нейтрализации;
4. оксида кальция с водой;
5. алюминия с серной кислотой.
2 24. Химическое равновесие системы 2NO + O2 2NO2 + Q при повышении давления:
1. сместится влево;
2. сместится вправо;
3. не сместится;
4. резко сместится влево;
5. сместится влево, а затем вправо.
225. Гетерогенной является реакция взаимодействия:
1. оксида углерода (II) с кислородом;
2. серы с кислородом;
3. раствора гидроксида натрия с соляной кислотой;
4. оксида азота (II) с кислородом;
5. растворов хлорида натрия и нитрата серебра.
2 26. Химическое равновесие системы N2 + 3H2 2NH3 + Q сместится вправо:
1. при уменьшении давления;
2. при увеличении концентрации аммиака;
3. при уменьшении концентрации азота;
4. при уменьшении температуры;
5. при увеличении температуры.
227. К галогенам относится:
1. марганец;
2. бром;
3. кислород;
4. теллур;
5. сера.
228. Электронная формула 1s22s22p5 отражает строение электронной оболочки атома:
1. хлора;
2. йода;
3. фтора;
4. астата;
5. брома.
229. Простое вещество йод представляет собой:
1. газ светло-зеленого цвета;
2. легко сжижающийся газ желто-зеленого цвета;
3. твердое вещество серо-стального цвета с металлическим блеском;
4. тяжелая жидкость красно-бурого цвета;
5. газ бурого цвета.
230. Наиболее ярко окислительные свойства выражены у:
1. брома;
2. йода;
3. хлора;
4. фтора;
5. астата.
231. Среди кислот, содержащих хлор, самой сильной является:
1. хлорноватистая;
2. хлористая;
3. хлорноватая;
4. хлорная;
5. хлороводородная.
232. Бром не взаимодействует с:
1. кислородом;
