
- •Содержание и цели термодинамики. Основные определения. Термодинамическая система, термодинамические параметры, функции состояния.
- •Идеальный газ. Уравнение состояния. Закон Дальтона. Реальные газы.
- •4.Теплоемкость. Молярная, удельная, изохорная, изобарная теплоемкость. Зависимость теплоемкости от температуры.
- •5. Стандартное состояние вещества. Стандартная теплота образования..
- •6. Тепловой эффект химической реакции. Закон Гесса.
- •7. Второй закон термодинамики. Энтропия.
- •8. Энергия Гиббса, стандартная энергия Гиббса. Понятие о химическом потенциале.
- •10. Уравнение изотермы химической реакции. Определение направления химической реакции.
- •11.Принцип смещения равновесий. Примеры его использования.
- •1 2. Оценка состава и свойств газовой атмосферы со –со2 –о2. Условие окисления металла в газовой атмосфере, диссоциации оксида металла.
- •13. Правило фаз Гиббса. Его использование.
- •14. Фазовые превращения 1-го и 2-го рода. Насыщенный пар, упругость пара и ее зависимость от температуры, теплота превращений.
- •15. Фазовые однокомпонентные диаграммы. Уравнение Клапейрона-Клаузиуса.
- •16. Фазовые диаграммы двухкомпонентных систем: компоненты а и в …… (3 фрагмента).
- •18. Растворы. Идеальные растворы. Законы Рауля и Генри. Термодинамическая активность.
- •19. Термодинамические параметры взаимодействия, их использование в расчетах.
- •20. Активность и коэффициент активности компонента металлического раствора и их расчет.
- •21. Кинетика и ее задачи. Кинетическое уравнение. Константа скорости и ее зависимость от температуры (уравнение Аррениуса) , порядок реакции, энергия активации и их определение.
- •22. Гетерогенные процессы. Диффузионная и кинетическая области реагирования. Лимитирующая стадия.
- •23. Концентрационный кислородный гальванический элемент с твердым электролитом. Его устройство, принцип работы. Схема измерения эдс. Температурные пределы использования кислородных датчиков.
- •29. Поверхностно активные вещества. Пав в расплаве железа, их влияние на поверхностное натяжение, краевой угол смачивания .
- •30. Вывести уравнение для расчета растворимости водорода (азота) в жидкой стали
22. Гетерогенные процессы. Диффузионная и кинетическая области реагирования. Лимитирующая стадия.
Реакции, в которых реагирующие вещества находятся в разных фазах, называются гетерогенными
Гетерогенные процессы, связанные с переносом реагентов из объема фаз к поверхности, где происходит химическая реакция, и отводом от нее продуктов реакции, являются многостадийными
Перенос вещества называется массопереносом.
Различают внешнюю и внутреннюю массопередачу.
Скорость многостадийного процесса определяется скоростью самой медленной стадии, которая называется лимитирующей.
Кинетика реакций, в которых наиболее медленным звеном является перенос вещества (подвод или отвод реагентов) , называется диффузионной кинетикой.
Процесс идет в диффузионной области(лимитирует диффузия),
Процесс идет в кинетической области (лимитирует химическая реакция)
В металлургических процессах часто скорость химической реакции высока и не лимитирует скорость процесса.
23. Концентрационный кислородный гальванический элемент с твердым электролитом. Его устройство, принцип работы. Схема измерения эдс. Температурные пределы использования кислородных датчиков.
Гальванический элемент - устройство, преобразующее химическую энергию в электрическую.

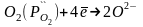 Электродные реакции на границах: 1.
Электродные реакции на границах: 1.
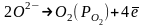
2.
Электрод II теряет электроны и становится положительно заряженным, электрод I приобретает электроны и становится отрицательно заряженным.
2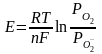 4.
Уравнение Нернста. Его получение и
использование в расчетах.
4.
Уравнение Нернста. Его получение и
использование в расчетах.
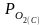
- равновесное парциальное давление кислорода в электроде сравнения (известно)
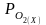
- равновесное парциальное давление кислорода в исследуемой фазе
( нужно определить)
нужно определить)
25. Учет в расчетах электронной проводимости твердых электролитов.
26. Электроды сравнения в кислородных датчиках и определение равновесного парциального
давления кислорода в электродах Ме-МеО для высокотемпературных измерений.
27. Расчет активности кислорода в металлическом расплаве по результатам эл.хим.измерений.
28. Поверхностное и межфазное натяжение, работа адгезии и когезии, адсорбция, уравнение адсорбции Гиббса,они определяются.кой сталирхностное натяжение,краевой угол смачиванияений, характеристики смачивания и растекания.
Поверхностное натяжение или коэффициент поверхностного натяжения – величина, численно равная работе обратимого изотермического образования поверхности.
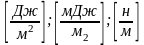
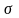
П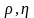 оверхностное
натяжение характеризует прочность
межчастичных связей ( как и )
оверхностное
натяжение характеризует прочность
межчастичных связей ( как и )
Чтобы увеличить или создать поверхность раздела фаз, нужно
затратить работу.
Р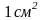
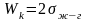 АБОТА
КОГЕЗИИ - это работа, затраченная
против сил межчастичного взаимодействия
при обратимом изотермическом разрыве
столба однородной жидкости сечением,
равным , то есть это работа по
созданию двух новых единиц поверхности.
АБОТА
КОГЕЗИИ - это работа, затраченная
против сил межчастичного взаимодействия
при обратимом изотермическом разрыве
столба однородной жидкости сечением,
равным , то есть это работа по
созданию двух новых единиц поверхности.
РАБОТА АДГЕЗИИ – работа, затрачиваемая по разрыву двух
н есмешивающихся жидкостей на границе раздела
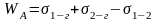 1,2-жидкости.
1,2-жидкости.
А ДСОРБЦИЯ
– это изменение поверхностного
натяжения вещества под действием
изменения состава поверхностного слоя.
ДСОРБЦИЯ
– это изменение поверхностного
натяжения вещества под действием
изменения состава поверхностного слоя.

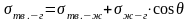
В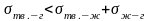 состоянии равновесия:
состоянии равновесия:
Если -стягивание капли
Е сли
- растекание капли.
сли
- растекание капли.
