
- •Содержание и цели термодинамики. Основные определения. Термодинамическая система, термодинамические параметры, функции состояния.
- •Идеальный газ. Уравнение состояния. Закон Дальтона. Реальные газы.
- •4.Теплоемкость. Молярная, удельная, изохорная, изобарная теплоемкость. Зависимость теплоемкости от температуры.
- •5. Стандартное состояние вещества. Стандартная теплота образования..
- •6. Тепловой эффект химической реакции. Закон Гесса.
- •7. Второй закон термодинамики. Энтропия.
- •8. Энергия Гиббса, стандартная энергия Гиббса. Понятие о химическом потенциале.
- •10. Уравнение изотермы химической реакции. Определение направления химической реакции.
- •11.Принцип смещения равновесий. Примеры его использования.
- •1 2. Оценка состава и свойств газовой атмосферы со –со2 –о2. Условие окисления металла в газовой атмосфере, диссоциации оксида металла.
- •13. Правило фаз Гиббса. Его использование.
- •14. Фазовые превращения 1-го и 2-го рода. Насыщенный пар, упругость пара и ее зависимость от температуры, теплота превращений.
- •15. Фазовые однокомпонентные диаграммы. Уравнение Клапейрона-Клаузиуса.
- •16. Фазовые диаграммы двухкомпонентных систем: компоненты а и в …… (3 фрагмента).
- •18. Растворы. Идеальные растворы. Законы Рауля и Генри. Термодинамическая активность.
- •19. Термодинамические параметры взаимодействия, их использование в расчетах.
- •20. Активность и коэффициент активности компонента металлического раствора и их расчет.
- •21. Кинетика и ее задачи. Кинетическое уравнение. Константа скорости и ее зависимость от температуры (уравнение Аррениуса) , порядок реакции, энергия активации и их определение.
- •22. Гетерогенные процессы. Диффузионная и кинетическая области реагирования. Лимитирующая стадия.
- •23. Концентрационный кислородный гальванический элемент с твердым электролитом. Его устройство, принцип работы. Схема измерения эдс. Температурные пределы использования кислородных датчиков.
- •29. Поверхностно активные вещества. Пав в расплаве железа, их влияние на поверхностное натяжение, краевой угол смачивания .
- •30. Вывести уравнение для расчета растворимости водорода (азота) в жидкой стали
10. Уравнение изотермы химической реакции. Определение направления химической реакции.
Уравнение изотермы химической реакции позволяет определить
в еличину
еличину
Известно, что направление химической реакции определяется знакомизменения энергии Гиббса.
ДельтаG<0 реакция идет в прямом направлении( слева направо),
ДельтаG>0 произвольно, в обратном направлении,
ДельтаG=0 состояние равновесия.
11.Принцип смещения равновесий. Примеры его использования.
Равновесие смещается в направлении, обратном оказанному на систему внешнему воздействию. Применяя принцип ЛеШателье, можно качественно определить влияние температуры и давления на положение равновесия и предсказать, какие условия будут способствовать протеканию процесса в желаемом направлении. Если в процессе образуется большее число газообразных молей веществ, чем вступает в реакцию, то для смещения равновесия вправо необходимо понижать давление в системе. Если процесс идет с уменьшением числа молей газообразных компонентов, то чтобы повысить его эффективность, нужно повысить давление в системе.
1 2. Оценка состава и свойств газовой атмосферы со –со2 –о2. Условие окисления металла в газовой атмосфере, диссоциации оксида металла.
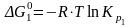
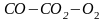
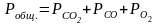
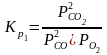
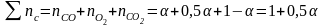
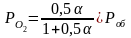
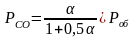
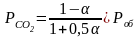
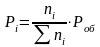
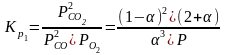

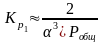
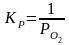
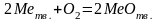
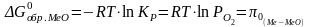
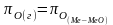
-газовая фаза, металл и оксид металла находятся в равновесии.
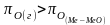 -происходит окисление
металла и образование оксида
-происходит окисление
металла и образование оксида

-кислород из системы Ме – МеО должен переходить в газовую фазу, то есть должно происходить выделение металла.
13. Правило фаз Гиббса. Его использование.
При рассмотрении систем со многими компонентами необходимо знать
число фаз, существующих при равновесии, и изменение числа фаз при изменении одного из параметров системы.
Правило фаз представляет уравнение:
С = К + n – f
C – число степеней свободы;
К – число компонентов;
n – параметры системы;
f – число фаз.
Число компонентов К – число индивидуальных веществ, входящих в систему, за вычетом числа химических уравнений, связывающих эти вещества.
Число степеней свободы С – это число параметров(T, P, концентрации),
которые полностью определяют состояние системы при равновесии и
которые можно менять в определенных пределах без изменения числа и
природы фаз.
Часто n=2 (T, P). Если рассматриваются системы с конденсированными
фазами, где давление часто не оказывает влияние на состояние системы,
правило фаз принимает вид.
С = К + 1 – f
Число степеней свободыи не может быть меньше нуля.
Правило фаз используют при рассмотрении диаграмм состояний и применят для анализа систем, в которых проходят химические превращения.
 В
соответствии с правилами фаз Гиббса
В
соответствии с правилами фаз Гиббса
для однокомпонентной системы
с=1+2-f
При наличии одной фазы с=2 – система бивариантна, если в равновесии две фазы, то с=1 (моновариантна), если в равновесии находятся три фазы с=0 (система нонвариантна).

