
- •Содержание и цели термодинамики. Основные определения. Термодинамическая система, термодинамические параметры, функции состояния.
- •Идеальный газ. Уравнение состояния. Закон Дальтона. Реальные газы.
- •4.Теплоемкость. Молярная, удельная, изохорная, изобарная теплоемкость. Зависимость теплоемкости от температуры.
- •5. Стандартное состояние вещества. Стандартная теплота образования..
- •6. Тепловой эффект химической реакции. Закон Гесса.
- •7. Второй закон термодинамики. Энтропия.
- •8. Энергия Гиббса, стандартная энергия Гиббса. Понятие о химическом потенциале.
- •10. Уравнение изотермы химической реакции. Определение направления химической реакции.
- •11.Принцип смещения равновесий. Примеры его использования.
- •1 2. Оценка состава и свойств газовой атмосферы со –со2 –о2. Условие окисления металла в газовой атмосфере, диссоциации оксида металла.
- •13. Правило фаз Гиббса. Его использование.
- •14. Фазовые превращения 1-го и 2-го рода. Насыщенный пар, упругость пара и ее зависимость от температуры, теплота превращений.
- •15. Фазовые однокомпонентные диаграммы. Уравнение Клапейрона-Клаузиуса.
- •16. Фазовые диаграммы двухкомпонентных систем: компоненты а и в …… (3 фрагмента).
- •18. Растворы. Идеальные растворы. Законы Рауля и Генри. Термодинамическая активность.
- •19. Термодинамические параметры взаимодействия, их использование в расчетах.
- •20. Активность и коэффициент активности компонента металлического раствора и их расчет.
- •21. Кинетика и ее задачи. Кинетическое уравнение. Константа скорости и ее зависимость от температуры (уравнение Аррениуса) , порядок реакции, энергия активации и их определение.
- •22. Гетерогенные процессы. Диффузионная и кинетическая области реагирования. Лимитирующая стадия.
- •23. Концентрационный кислородный гальванический элемент с твердым электролитом. Его устройство, принцип работы. Схема измерения эдс. Температурные пределы использования кислородных датчиков.
- •29. Поверхностно активные вещества. Пав в расплаве железа, их влияние на поверхностное натяжение, краевой угол смачивания .
- •30. Вывести уравнение для расчета растворимости водорода (азота) в жидкой стали
Содержание и цели термодинамики. Основные определения. Термодинамическая система, термодинамические параметры, функции состояния.
Термодинамика-наука о превращении тепла в работу. Т: общая, техническая, химическая. Т имеет дело с начальным и конечным состоянием вещества. СИСТЕМА – совокупность тел, фактически или мысленно выделяемых
из окружающей среды.
ИЗОЛИРОВАННАЯ СИСТЕМА-не может обмениваться с окружающей средой ни энергией, ни веществом и имеет постоянный объем и энергию.
ОТКРЫТАЯ СИСТЕМА – находится в состоянии обмена с окружающей
средой по массе и по энергии. Она не имеет постоянного объема.
КОМПОНЕНТ – химически индивидуальное вещество, которое может быть выделено из системы и существовать самостоятельно.
(Для характеристики системы не обязательно знать все параметры,
можно ограничиться лишь некоторыми).
ПАРАМЕТРЫ, которые выбирают в качестве независимых переменных и которые
определяют состояние системы, называют параметрами состояния системы.
(Обычно это такие параметры, величину которых можно измерить:
температура, объем, давление, концентрация.)
Окружающая среда, как и сама система, обладает также определенными
свойствами и характеризуется параметрами. Эти параметры по отношению
к системе будут внешними, обычно это температура и давление.
СОСТОЯНИЕ СИСТЕМЫ НАЗЫВАЕТСЯ РАВНОВЕСНЫМ, если все параметры состояния имеют определенные значения и не изменяются во времени.
СОСТОЯНИЕ СИСТЕМЫ ЯВЛЯЕТСЯ НЕРАВНОВЕСНЫМ, если
хотя бы один из параметров не имеет определенного значения.
ТЕРМОДИНАМИЧЕСКИЙ ПРОЦЕСС – есть переход системы из
одного состояния равновесия в другое. Этому соответствует изменение одного или
нескольких параметров системы.
РАВНОВЕСНЫЙ ПРОЦЕСС представляется состоящим из бесконечно
большого числа последовательных равновесных состояний при условии, что протекает бесконечно медленно.
ОБРАТИМЫЙ ПРОЦЕСС – если система, вкоторой протекает равновесный процесс, может вернуться в исходное состояние, причем, при возвращении
она проходит через те же равновесные состояния, что и в прямом
направлении.
ОБРАТИМЫЙ ПРОЦЕСС – если система, вкоторой протекает равновесный процесс, может вернуться в исходное состояние, причем, при возвращении
она проходит через те же равновесные состояния, что и в прямом
направлении.
МОЛЬ-количество вещества, содержащее столько структурных единиц
(частиц-молекул, атомов), сколько атомов содержится в 12 г углерода
Число атомов в 12 г углерода – постоянная Авогадро
Идеальный газ. Уравнение состояния. Закон Дальтона. Реальные газы.
Модель идеального газа
1.Молекулы (атомы)принимаются за материальные точки с определенной массой.Размеры их ничтожны по сравнению с расстоянием между ними.
2.Молекулы(атомы) находятся в состоянии непрерывного и постоянного движения.Между столкновениями они движутся прямолинейно. Движения равновероятны по всем направлениям.
3.Скорости частиц могут быть любыми.
4.При столкновении молекулы (атомы)ведут себя как упругие шары.
Между частицами не действуют силы притяжения или отталкивания
У![]() равнение
ид газа:
равнение
ид газа:
V-молярный объём, R-молярная газовая постоянная.
З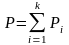 акон
Дальтона. Общее давление смеси идеальных
газов равно сумме парциальных
акон
Дальтона. Общее давление смеси идеальных
газов равно сумме парциальных
давлений компонентов.
Парциальное давление компонентов в смеси, это давление,
которое он оказывает, занимая весь тот объем, что и смесь, при той же
температуре.
При повышении плотности изменяются свойства газов – они перестают быть идеальными. Простейшим уравнением, которое качественно правильно описывает отличие реального газа от идеального, является уравнение Ван-дер-Ваальса
3. Внутренняя энергия и энтальпия. Первый закон термодинамики.
Характеризует общий запас энергии системы, включает все виды движения и взаимодействия частиц, составляющих систему.
Так, внутренняя энергия U тела складывается из кинетической энергии
движущихся молекул и потенциальной энергии, т.е. энергии взаимного
притяжения и отталкивания частиц (молекул).
Во внутреннюю энергию также входят: энергия электронов, ядерная энергия и т.д.
Внутренняя энергия U системы (тела) должна зависеть от температуры
Т (кинетическая энергия молекул) и от объема V , так как потенциальная энергия – энергия взаимного притяжения и отталкивания, зависит от расстояния между молекулами.
П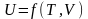 отому
отому
Внутренняя энергия не может равняться нулю (нет веществ без
движения).
Она всегда положительна и тем больше, чем больше движение.
2. Внутренняя энергия изолированной системы всегда остается
постоянной величиной, независимо от протекающих в системе процессов.
3. Внутренняя энергия складывается из отдельных видов энергии,
которые превращаются друг в друга в строго эквивалентных количествах.
4. Внутренняя энергия является однозначной функцией состояния
системы, т.е. каждому состоянию системы соответствует одно значение
внутренней энергии. Абсолютное значение внутренней энергии системы
определить невозможно, но в термодинамике это и не нужно.
Достаточно знать изменение внутренней энергии при переходе
системы из одного состояния в другое.
Первый закон термодинамики является обобщением закона сохранения и превращения энергии для термодинамической системы. Он формулируется следующим образом: Изменение ΔU внутренней энергии неизолированной термодинамической системы равно разности между количеством теплоты Q, переданной системе, и работой A, совершенной системой над внешними телами.
|
|
