
- •3. Законы Ньютона:
- •4. Силы трения, притяжения, упругие.
- •7. Энергия. Работа. Закон сохранения энергии.
- •8. Консервативные силы. Потенциальная энергия во внешнем поле сил.
- •28. Опытные законы идеального газа.
- •34. Хаотичность молекулярного движения. Статистические закономерности. Распределение молекул по объему.
- •35. Броуновское движение. Опыт Штерна.
- •36. Закон теплопроводности Фурье. Диффузия.
- •37. Число степеней свободы. Закон равномерного распределения молекул по степеням свободы молекул
- •38. Внутренняя энергия системы. Первое начало термодинамики
- •39. Работа, совершаемая газом при изменениях объема
- •40. Внутренняя энергия и теплоемкость идеального газа
- •41. Изопроцессы.
- •46. Реальные газы. Силы и потенциальная энергия межмолекулярного взаимодействия.
- •47. Уравнение Ван-дер-Ваальса.
- •48. Изотермы Ван-дер-Ваальса и их анализ.
- •49. Внутренняя энергия реального газа. Эффект Джоуля-Томсона.
- •50. Сжижение газов.
- •51. Свойства жидкостей. Поверхностное натяжение. Смачивание. Капиллярные явления.
- •52. Фазовые переходы первого и второго рода. Диаграмма состояния. Тройная точка.
- •53. Колебания и волны. Гармонические колебания и их характеристики. Свободные колебания.
- •54. Дифферинциальное уравнение свободных затухающих коллебаинй и его решение.
- •55. Механические гармонические колебания. Гармонический осциллятор. Пружинный, физический и математический маятники.
- •56. Сложение гармонических колебаний одного направления и одинаковой частоты. Биения.
- •57. Сложение взаимно-перпендикулярных колебаний.
- •58. Волновое движение. Плоская бегущая волна.
- •59. Уравнение плоской волны.
- •60. Фазовая и групповая скорость.
- •61. Интерференция волн. Образование стоячих волн.
38. Внутренняя энергия системы. Первое начало термодинамики
Вну́тренняя эне́ргия тела (обозначается как E или U) — это сумма энергий молекулярных взаимодействий и тепловых движений молекулы.
Внутреннюю
энергию тела нельзя измерить напрямую.
Можно определить только изменение
внутренней энергии:
![]()
Первое начало термодинамики — один из трёх основных законов термодинамики, представляет собой закон сохранения энергии для термодинамических систем.
Количество
теплоты, полученное системой, идёт на
изменение её внутренней энергии и
совершение работы против внешних сил.
![]()
39. Работа, совершаемая газом при изменениях объема
![]()
40. Внутренняя энергия и теплоемкость идеального газа
Т![]() еплоемкость
идеального газа — это отношение
количества теплоты, сообщенного газу,
к изменению температуры δТ, которое при
этом произошло.
еплоемкость
идеального газа — это отношение
количества теплоты, сообщенного газу,
к изменению температуры δТ, которое при
этом произошло.
41. Изопроцессы.
Изопроцессы — термодинамические процессы, во время которых количество вещества и ещё одна из физических величин — параметров состояния: давление, объём или температура — остаются неизменными. Так, неизменному давлению соответствует изобарный процесс, объёму — изохорный, температуре — изотермический, энтропии — изоэнтропийный (например, обратимый адиабатический процесс)
![]() Изобарный
процесс —
процесс изменения состояния
термодинамической системы при постоянном
давлении (
Изобарный
процесс —
процесс изменения состояния
термодинамической системы при постоянном
давлении (![]() )
)
И![]() зохорный
процесс (от
греч. хора — занимаемое место) —
процесс изменения состояния
термодинамической системы при постоянном
объёме (
зохорный
процесс (от
греч. хора — занимаемое место) —
процесс изменения состояния
термодинамической системы при постоянном
объёме (![]() ).
).
Изотермический
процесс (от
греч. «термос» — тёплый, горячий) —
процесс изменения состояния
термодинамической системы при постоянной
температуре (![]() )(
)(![]() ).
).
PV = const
![]() Изоэнтропийный
процесс —
процесс изменения состояния
термодинамической системы при постоянной
энтропии (
Изоэнтропийный
процесс —
процесс изменения состояния
термодинамической системы при постоянной
энтропии (![]() ).
).
42. Уравнение адиабаты идеального газа.
Для идеальных газов, чью теплоёмкость можно считать постоянной, в случае квазистатического процесса адиабата имеет простейший вид и определяется уравнение
![]()
где ![]() —
его объём,
—
его объём, ![]() — показатель
адиабаты,
— показатель
адиабаты, ![]() и
и ![]() — теплоёмкости газа
соответственно при постоянном давлении
и постоянном объёме.
— теплоёмкости газа
соответственно при постоянном давлении
и постоянном объёме.
43. Применение первого начала термодинамики к изопроиессам.
И![]() зохорный
процесс (V=const).
зохорный
процесс (V=const).
![]() Тогда
для произвольной массы газа получим
Тогда
для произвольной массы газа получим
И![]() зобарный
процесс (p=const).
зобарный
процесс (p=const).
Изотермический процесс (T=const).
44. Энтропия.
![]() Энтропи́я в статистической
физике — меравероятности осуществления
какого-либо макроскопического
состояния
Энтропи́я в статистической
физике — меравероятности осуществления
какого-либо макроскопического
состояния
где ![]() —
приращение энтропии;
—
приращение энтропии; ![]() —
минимальная теплота, подведенная к
системе; T — абсолютная температура
процесса;
—
минимальная теплота, подведенная к
системе; T — абсолютная температура
процесса;
45. Второе начало термодинамики. Цикл Карно и его КПД для идеального газа.
Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.
 Постулат Клаузиуса: «Невозможен
процесс, единственным результатом
которого являлась бы передача тепла от
более холодного тела к более горячему»
Постулат Клаузиуса: «Невозможен
процесс, единственным результатом
которого являлась бы передача тепла от
более холодного тела к более горячему»
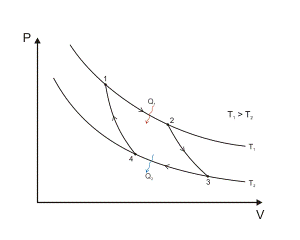
Цикл Карно́ — идеальный термодинамический цикл.
Коэффициент полезного действия тепловой машины Карно равен
![]()
Цикл Карно состоит из четырёх стадий:
Изотермическое расширение. В начале процесса рабочее тело имеет температуру Тн, то есть температуру нагревателя. Затем тело приводится в контакт с нагревателем, который изотермически (при постоянной температуре) передаёт ему количество теплоты Qн. При этом объём рабочего тела увеличивается.
Адиабатическое (изоэнтропическое) расширение . Рабочее тело отсоединяется от нагревателя и продолжает расширяться без теплообмена с окружающей средой. При этом его температура уменьшается до температуры холодильника.
Изотермическое сжатие. Рабочее тело, имеющее к тому времени температуру , приводится в контакт с холодильником и начинает изотермически сжиматься, отдавая холодильнику количество теплоты .
Адиабатическое (изоэнтропическое) сжатие. Рабочее тело отсоединяется от холодильника и сжимается без теплообмена с окружающей средой. При этом его температура увеличивается до температуры нагревателя.
