
- •Понятие вакуума. Применение вакуума в науке и технике.
- •Основные термины и определения.
- •Понятие о вакууме и давлении. Степени вакуума в зависимости от критерия Кнудсса.
- •Газовые законы.
- •Частота соударений молекул газа с поверхностью. Единицы давления.
- •Распределение молекул газа по скоростям.
- •Средняя длина свободного пути.
- •Энергия взаимодействия при физической адсорбции и хемосорбции.
- •Время адсорбции.
- •Конденсация и испарение.
- •Адсорбция газов и паров.
- •Степени покрытий поверхности.
- •Диффузия в газах.
- •Вязкость газов в вакууме.
- •Перенос теплоты в вакууме.
- •Скольжение разряженных газов.
- •Температурный скачок.
- •Основные определения вакуумной техники.
- •Сопротивление и проводимость сложного вакуумного трубопровода.
- •Основные уравнения вакуумной техники.
- •Процессы изменения состояния газа в вакуумных системах.
- •Критерии определения режимов течения газа в трубопроводах.
- •Переход от турбулентного режима течения к вязкостному
- •Переход от вязкостного режима течения к молекулярному
- •Расчёт длительности откачки.
- •Деформационные преобразователи.
- •Гидростатические преобразователи.
- •Тепловые преобразователи.
- •Электронные преобразователи.
- •Магнитные преобразователи.
- •Радиоизотопные преобразователи.
- •Градуировка преобразователей.
- •Методы измерения газовых потоков.
- •Методы течеискания.
- •Измерение парциальных давлений.
- •Распределение давления в вакуумной системе при стационарном режиме работы.
- •Параллельное соединение арматуры в откачиваемых объектах.
- •Последовательное соединение арматуры в откачиваемых объектах.
- •Параллельное соединение насосов.
- •Последовательное соединение насосов.
- •Расчёт газовых нагрузок.
Газовые законы.
Если в объеме находится смесь из К газов, то давление смеси:
 (1.8)
(1.8)
или
 (1.9)
– закон Дальтона.
(1.9)
– закон Дальтона.
Т.
к. температура, согласно 4 постулату,
пропорциональна кинетической энергии
молекулы, можно записать
 ,
,
где с – некоторая постоянная.
Тогда (1.7) можно записать в виде:
 .
.
Обозначим
 ,
тогда
,
тогда
 (1.10),
(1.10),
а средняя кинетическая энергия молекулы:
 (1.11)
(1.11)
Уравнение (1.10) называют уравнением газового состояния, оно связывает три основных параметра: давление, молекулярную концентрацию и температуру. Константа k=1.38∙10-23Дж/к – постоянная Больцмана.
Уравнение (1.10) также можно представить в виде:
 ,
(1.12),
,
(1.12),
где М – молекулярная масса газа; V – объём газа; NA=М/m=6.02∙1028 к моль-1 – число Авагадро; R=kNA=8.31∙103, Дж/Кмоль – универсальная газовая постоянная.
Частота соударений молекул газа с поверхностью. Единицы давления.
Число молекул, соударяющихся об единицу поверхности в единицу времени:

 (1.13)
(1.13)
С учетом функции распределения молекул по скоростям получаем
 ,
(1.14)
,
(1.14)
где Vар – средняя арифметическая скорость.
Объем газа, ударяющегося об единицу поверхности в единицу времени можно выразить через частоту соударений и молекулярную концентрацию
 (1.15)
(1.15)
Данное выражение не зависит от давления и определяет максимальную быстроту действия идеального вакуумного насоса, откачивающего все молекулы газа, которые попадают в него через входное отверстие.
Распределение молекул газа по скоростям.
При соударении друг с другом или со стенками вакуумной камеры молекулы изменяют свои скорости, как по величине, так и по направлению. Используя гипотезы о стационарном распределении по скоростям и изотропности пространства, Максвелл получил функцию распределения молекул по скоростям
 , (1.16)
, (1.16)
где dnV – число молекул скорости, которых находятся в пределах от V до 0.
Скорость, при которой наблюдаются максимальные функции распределения, называют наиболее вероятной скоростью
 . (1.17)
. (1.17)
Если
ввести обозначения
 ,
то получим
,
то получим
 .
.
Используются
безразмерная дифференциальная –
f(c)=dnV/(ndc)
b
и интегральная – F(c)= функции распределения молекул по
скоростям.
функции распределения молекул по
скоростям.
В расчетах также используют среднеарифметическую скорость
 (1.18)
(1.18)
и среднеквадратичную
 (1.19).
(1.19).
Соотношение между скоростями Vвер, Vар, Vкв составляет 1:1,128:1,225.
Кроме распределения по скоростям молекул имеются функции распределения по энергии
 ;
;
 ; (1.20)
; (1.20)
 ,
(1.21),
,
(1.21),
здесь
 .
.
Существуют
наиболее вероятная энергия
 и
среднеарифметическая
и
среднеарифметическая
 .
.
Средняя длина свободного пути.
Направленный молекулярный поток, содержащий в начальный момент N0 молекул газа с хаотично движущимися молекулами с частотой К за время dt, уменьшается на величину:
 ,
интегрируя, получаем
,
интегрируя, получаем
 .
.
 (1.22)
(1.22)
Средняя
длина свободного пути молекул газа
 ,
определяемая как отношение скорости
молекул к числу столкновений в единицу
времени.
,
определяемая как отношение скорости
молекул к числу столкновений в единицу
времени.
 – длина пути молекулы за время t,
столкновение произойдет в том случае,
если расстояние между центрами молекул
будет не более диаметра молекулы
– длина пути молекулы за время t,
столкновение произойдет в том случае,
если расстояние между центрами молекул
будет не более диаметра молекулы
 .
Будем считать, что одна молекула имеет
радиус
.
Будем считать, что одна молекула имеет
радиус
 ,
а все остальные математические точки
с нулевым радиусом. При движении со
скоростью
,
а все остальные математические точки
с нулевым радиусом. При движении со
скоростью
 с молекулярной концентрацией n,
за одну секунду такая воображаемая
молекула опишет объем
с молекулярной концентрацией n,
за одну секунду такая воображаемая
молекула опишет объем
 ,
и испытает
,
и испытает
 столкновений. Средняя длина свободного
пути в таком случае будет равна
столкновений. Средняя длина свободного
пути в таком случае будет равна
 . (1.23)
. (1.23)
С учетом относительных скоростей движения молекулы газа, которые не учитывались при выводе уравнения (1.23), для длины свободного пути можно получить более точное выражение
 .
(1.24)
.
(1.24)
Из (1.24) видно, что при постоянной молекулярной концентрации, длина свободного пути не должна зависеть от температуры.
Однако из опытных данных следует, что при n = const, средняя длина свободного пути увеличивается , данный фактор учитывается введением дополнительного модуля, тогда
 , (1.25)
, (1.25)
где С – постоянная Сезерленда, равная температуре при которой, в случае постоянной молекулярной концентрации газа, средняя длина свободного пути молекул уменьшается вдвое по сравнению со значением соответствующей бесконечно большой температуре [K] .
Для учета взаимодействия молекул между собой вводят понятие эффективного диаметра молекулы dТ, который уменьшается с увеличением температуры
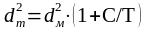 (1.26)
(1.26)
Уравнение (1.25) с учетом (1.26) можно записать в виде:
 .
.
Используя уравнение состояния (1.10), (1.26) можно записать в виде:
 (1.27)
(1.27)
Для воздуха, при Т=293 К, и Р=1Па из (1.27), L1= 6,7·10-3 МПа.
L1 – средняя длина свободного пути при Р=1Па.
При любом другом давлении
 (1.28)
(1.28)
При расчетах длины свободного пути при различных температурах и постоянном давлении из (1.27) можно получить
 (1.29)
(1.29)
В случаи смеси двух газов с массой молекул m1 и m2, L1 молекулы массой m1 рассчитывают по формуле:
 ;
(1.30)
;
(1.30)
 .
.
В случае, если n1« n2, получаем
 .
(1.31)
.
(1.31)
Формула Больцмана для определения давления воздуха на различной высоте z
 .
.
