
- •1. Термодинамика. Метод и законы. Основные понятия и определения термодинамики.
- •Основные понятия и определения
- •2. Параметры состояния и уравнения состояния. Отличия между идеальным и реальным газом.
- •3. Термодинамическая и потенциальная работы."p-V" координаты.
- •4. Теплоемкость. Определение теплоемкости веществ.
- •5. Диаграмма фазовых состояний. Критические параметры.
- •7. Смеси идеальных и реальных газов
- •8. Математическое выражение первого начала термодинамики
- •10. Первое начало термодинамики в аналитической форме.
- •11. Первое начало термодинамики для идеальных газов.
- •12. Принцип существования энтропии идеального газа.
- •13. Процессы изменения состояния (изобара, изохора, изотерма и адиабата) в "p-V" и "t-s" координатах.
- •14. Политропа с постоянным и переменным показателем. Показатели политропы.
- •15. Работа в термодинамических процессах простых тел.
- •16. Теплообмен в термодинамических процессах простых тел
- •17. Процессы изменения состояния идеального газа
- •18. Работа и теплообмен в политропных процессах идеальных газов.
- •19.Круговые процессы. Кпд и холодильный коэффициент.
- •20. Обратимый цикл Карно. Кпд и холодильный коэффициент.
- •21. Математическое выражение второго начала термостатики.
- •22. Следствия второго начала термостатики. "t-s" координаты.
- •23. Математическое выражение второго начала термодинамики.
- •28. Истечение несжимаемых жидкостей
- •29. Особенности истечения сжимаемой жидкости. Кризис истечения.
- •31. Дросселирование. Эффект Джоуля-Томсона
20. Обратимый цикл Карно. Кпд и холодильный коэффициент.

Рис. 12. Цикл Карно для теплового двигателя
Интегральные количество подведенной и отведенной теплоты в цикле Карно:
![]() =
=
![]() =
=
![]() ;
;
![]() =
=
![]() =
=
![]() .
.
Работа
цикла составляет
![]()
![]() .
.
![]() .
.
21. Математическое выражение второго начала термостатики.
Математическое
выражение второго начала классической
термодинамики может быть представлено
в виде следующего выражения:
![]() .
.
Второе начало термостатики
«температура есть единственная функция состояния, определяющая направление самопроизвольного теплообмена».
Математическое выражение второго начала термостатики - принципа существования энтропии и абсолютной температуры для любых равновесных систем
![]()
и для 1 кг системы
![]() .
.
22. Следствия второго начала термостатики. "t-s" координаты.
Следствие I. Совместное выражение первого начала термодинамики и второго начала термостатики позволяет получить дифференциальное уравнение термодинамики, которое связывает между собой все термодинамические свойства веществ
T
ds=
cv
dT
+
![]() =
cp
dT
+
=
cp
dT
+
![]() .
.
Следствие II. Координаты Т - S являются универсальными координатами термодинамического теплообмена.
Рис.
14. Термодинамический процесс в координатах
T-S
Рассмотрим процесс 1-2 в координатах Т-S и выделим на нем элементарный участок с температурой Т и изменением энтропии dS (рис. 14).
Q1,2
= Tm(S2
- S1).
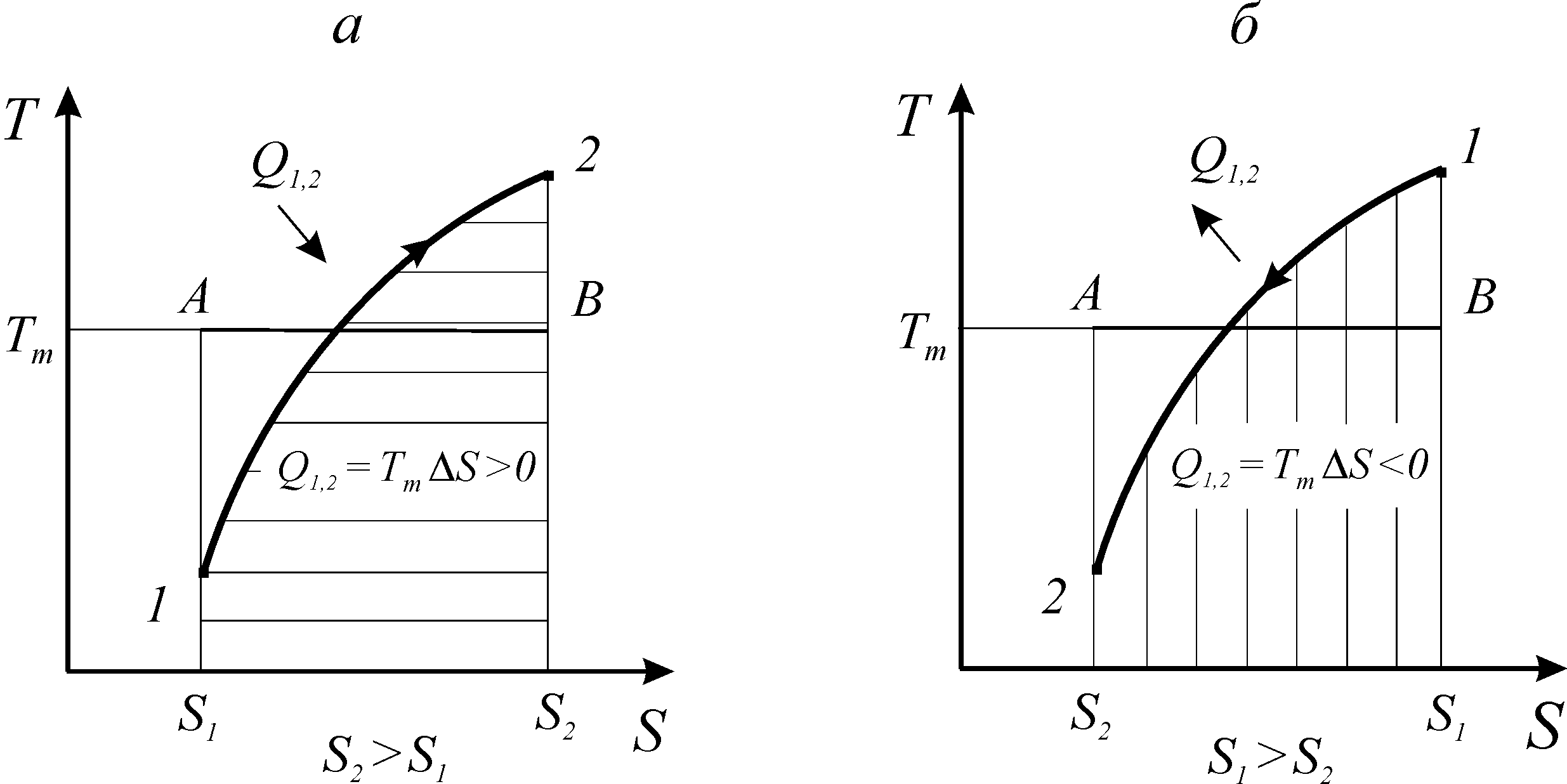
Рис. 15. Теплообмен в термодинамических процессах
Следствие III. Адиабатный процесс является процессом изоэнтропийным.
Показатель
адиабатного процесса (![]() )
равен показателю изоэнтропийного
)
равен показателю изоэнтропийного
процесса
(![]() )
)
![]() .
.
Следствие IV. Коэффициент полезного действия и холодильный коэффициент термодинамических циклов тепловых машин не зависят от вида цикла и природы рабочего тела, а определяются лишь средними абсолютными температурами рабочего тела в процессах подвода и отвода теплоты.
Количества подведенной и отведенной теплоты определяется по следующим соотношениям:
Q1=
![]() = Tm1
(
S2
-
S1
)
= Tm1
S1,2;
Q2=
= Tm2(
S2
-
S1
)
= Tm2
S1,2,
= Tm1
(
S2
-
S1
)
= Tm1
S1,2;
Q2=
= Tm2(
S2
-
S1
)
= Tm2
S1,2,
![]() =
=
![]() =1
-
=1
-
![]() .
.
![]() =
=
![]() =
=
![]() .
.
![]() .
.
Следствие
V.
Коэффициент
полезного действия и холодильный
коэффициент цикла Карно всегда выше
этих коэффициентов эффективности для
любых других термодинамических циклов
тепловых машин, осуществляемых в
одинаковом диапазоне предельных
температур рабочего тела (![]() ).
).
![]() ,
,
![]() .
.
Следствие VI. Изменение энтропии системы равно сумме изменений энтропии всех тел, входящих в систему (теорема аддитивности энтропии).
![]() .
.
