
- •Глава 2. Алканы
- •2.1. Номенклатура. Изомерия
- •2.2. Строение
- •2.3. Физические свойства
- •2.4. Химические свойства
- •2.4.1. Реакции радикального замещения
- •2.4.2. Реакции дегидрирования и разложения
- •2.4.3. Реакции изомеризации
- •Способы получения и природные источники
- •2.6. Применение и физиологическая роль
- •Вопросы и упражнения
- •1. Назовите по заместительной номенклатуре июпак:
- •2. Назовите по рациональной номенклатуре:
2.4.2. Реакции дегидрирования и разложения
Дегидрирование обычно протекает при температуре 800 – 900 К на поверхности таких металлов, как платина, палладий, никель или на оксиде хрома (III) по схеме:
R-СH2-СН3 R-CH=CH2 + H2 .
Механизм включает в себя адсорбцию алкана на поверхности катализатора, взаимодействие электронов -связей с вакантными d-орбиталями металла и, таким образом, внедрение атома металла в -связь С–Н :
 .
.
При этом при отщеплении одной молекулы водорода от молекулы высшего алкана обычно образуется смесь алкенов, являющихся изомерами как структурными, так и геометрическими.
Каталитическое дегидрирование алканов часто используют в промышленности. Этот процесс может сопровождаться разрывом С–С-связей (крекингом, пиролизом). При этом образуется смесь непредельных и предельных углеводородов с меньшей молекулярной массой:
 .
.
Промежуточными частицами являются свободные радикалы. Они образуются в результате гомолиза алканов как по связям С–С, так и по связям С–Н.

Алкильные радикалы (обычно разветвлённого строения) не только диспропорционируют с образованием алкана и алкена, но и претерпевают расщепление с разрывом углерод-углеродной связи (как правило, у разветвлённого атома углерода):
 .
.
(Такое превращение иногда называют -распадом, так как осколочный радикал отрывается от -углеродного атома по отношению к радикальному центру).
Радикалы также способны рекомбинировать, изомеризоваться или отщеплять атомы водорода от углеводородов. В таких реакциях образуется, как правило, смесь продуктов.
В промышленности крекингу (термическому или каталитическому) подвергают нефть, получая из неё топливо для двигателей внутреннего сгорания и другие ценные соединения.
2.4.3. Реакции изомеризации
Металлы некоторых переходных элементов способствуют отщеплению гидрид-ионов от алканов при повышенных температурах.
![]()
Образующийся карбокатион, отщепляя катион водорода, превращается в бутен-2. Такой процесс имеет место при каталитическом дегидрировании. однако наряду с этим направлением реакции может происходить нуклеофильная перегруппировка — перемещение метильной группы с электронной парой связи из -положения к положительному атому углерода этого карбокатиона:
 .
.
Получающийся изобутил-катион, присоединяя гидрид-ион, превращается в изобутан. При отщеплении от данного карбокатиона катиона водорода образуется в качестве побочного стабильного продукта изобутилен:
 .
.
В данном случае процесс изомеризации бутана в изобутан сопровождается дегидрированием алканов. В зависимости от условий проведения реакции можно осуществить изомеризацию и (или) дегидрирование алкана, что широко используется в промышленном органическом синтезе.
Способы получения и природные источники
Важнейшими природными источниками алканов являются нефть и природный газ. Нефть — не только топливо, но и ценное химическое сырьё для органического синтеза. Однако она относится к невозобновляемым ресурсам. Кроме того, алканы входят в состав природного горючего газа, попутного нефтяного газа, озокерита, горючих сланцев.
При разгонке нефти получаются различные смеси алканов, которые используются в виде следующих фракций: бензин (углеводороды С5 – С11), лигроин (углеводороды С8 – С14), керосин (углеводороды С12 – С18), дизельное топливо (углеводороды С14 – С25), смазочные масла (углеводороды С20 – С34), вазелин, твёрдый парафин, гудрон. Высшие фракции разгонки нефти подвергают крекингу для получения высокосортных бензинов.
Попутными нефтяными газами являются, главным образом, растворённые в нефти метан, этан, пропан, бутан и пентан примерно в равных количествах, но обычно с преобладанием метана (иногда до 50%).
Метан встречается в природе также как болотный газ, рудничный газ. Наибольшее содержание метана в природном горючем газе (от 60% до 99%), а этан, пропан и бутан встречаются в нём в качестве примеси.
Перспективным источником получения метана и ряда других веществ, представляющих интерес как топливные материалы, является микробиологический способ переработки, в том числе и биоотходов. Ежегодный прирост биомассы на Земле составляет более 200 млрд. т. При воздействии анаэробных микробов (развивающихся без доступа кислорода), например, на целлюлозу образуется в качестве одного из продуктов метан:
(C6H10O5)n + nH2O 3nCO2 + 3nСН4 .
Алканы могут быть получены из метана, который подвергают конверсии с водяным паром на никелевом катализаторе при температуре 1000 – 1050 К.
CH4 + H2O CO + 3H2
Образующийся при этом синтез-газ в более мягких условиях (в присутствии никелевого или кобальтового катализатора при температуре 450 – 500 К) превращается в углеводороды и водяной пар:
nCO + (2n+1)H2 CnH2n+2 + nH2O .
Этот метод используется в технике для получения синтетического бензина.
Другими синтетическими способами алканов являются:
гидрирование непредельных углеводородов в присутствии катализатора (Ni, Pt, Pd):
СН2=СН2 + Н2 СН3СН3
СНСН + 2Н2 СН3СН3
(подробнее эти реакции будут рассмотрены в свойствах соответствующих углеводородов);
восстановлением йодоводородом при нагревании производных алканов (йодалканов, спиртов — гл. 3.2.2.3, 3.3.3.1):
R–I + HI RH + I2
R–OH + 2HI RH + I2 + H2O;
из галогеналканов (гл. 3.2.2.3)
а) через магнийорганические соединения
R–Br + Mg R–MgBr
R–MgBr + H2O RH + Mg(OH)Br ,
б) по реакции Вюрца*
2R–Br + 2Na R–R + 2NaBr ;
при сплавлении солей карбоновых кислот со щелочами в лабораторных условиях при 500 – 600 К можно получить метан:
 ,
,
но эта реакция может быть использована и для получения других низших алканов (подробнее будет рассмотрена в свойствах карбоновых кислот — гл. 6.4.4.4);
гидролиз карбида алюминия удобный способ получения метана в лаборатории:
Al4C3 + H2O CH4 + Al(OH)3 ;
электролиз натриевых и калиевых солей монокарбоновых кислот по Кольбе* способ получения алканов с чётным числом атомов углерода в молекуле:
![]()
R + R R–R ;
из альдегидов и кетонов по реакции Кижнера*-Вольфа*:
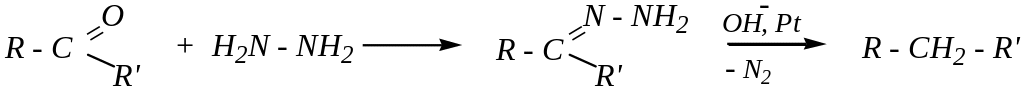
(эта реакция также будет рассмотрена позже, в свойствах карбонильных соединений — гл. 6.1.4.1).
