
- •Статистический метод в физике
- •Термодинамический метод в физике
- •Термодинамическая характеристика состояния тел и термодинамические процессы
- •Основные уравнения модели идеального газа
- •Основное уравнение молекулярно-кинетической теории идеальных газов
- •Закон Маквелла о распределении молекул идеального газа по скоростям и энергиям теплового движения
- •Барометрическая формула. Распределение Больцмана
- •Среднее число столкновений и средняя длина свободного пробега молекул
- •Опытное обоснование молекулярно-кинетической теории
- •Явления переноса в термодинамически неравновесных системах
- •Вакуум и методы его получения. Свойства ультраразреженных газов
- •Закон равномерного распределения энергии по степеням свободы молекул
- •Первое начало термодинамики
- •Работа газа при изменении его объема
- •Теплоемкость. Уравнение Майера
- •Адиабатический процесс. Политропный процесс
- •Круговой процесс (цикл). Обратимые и необратимые процессы
- •Энтропия, ее статистическое толкование и связь с термодинамической вероятностью
- •Второе начало термодинамик
- •Цикл Карно
- •Реальные газы, жидкости и твердые тела
- •Уравнение Ван-дер-Ваальса
- •Изотермы Ван-дер-Ваальса и их анализ
- •Внутренняя энергия реального газа
- •Эффект Джоуля — Томсона
- •Сжижение газов
- •Свойства жидкостей. Поверхностное натяжение
- •Смачивание
- •Капиллярные явления
- •Твердые тела. Моно- и поликристаллы
- •§ 31. Типы кристаллических твердых тел
- •§ 32. Дефекты в кристаллах
- •§ 33. Теплоемкость твердых тел
- •§ 34. Испарение, сублимация, плавление и кристаллизация. Аморфные тела
- •§ 35. Фазовые переходы I и п рода
- •§ 36. Диаграмма состояния. Тройная точка
- •§ 37 Понятие о зонной теории твердых тел
- •§ 38. Металлы, диэлектрики и полупроводники по зонной теории
- •§ 39 Собственная проводимость полупроводников
- •§ 40. Примесная проводимость полупроводников
- •§ 41. Фотопроводимость полупроводников
- •§ 42. Люминесценция твердых тел
- •§ 43. Контакт двух металлов по зонной теории
- •§ 44. Термоэлектрические явления и их применение
- •§ 45. Выпрямление на контакте металл — полупроводник
- •§ 46. Размер, состав и заряд атомного ядра. Массовое и зарядовое числа
- •§ 47. Дефект массы и энергия связи ядра
- •§ 48. Спин ядра и его магнитный момент
- •§ 49 Ядерные силы. Модели ядра
- •§ 50. Радиоактивное излучение и его виды
- •§ 51. Закон радиоактивного распада. Правила смещения
- •§ 52. Закономерности -распада
- •§ 54. Гамма-излучение и его свойства
- •§ 55. Резонансное поглощение -излучения (эффект Мёссбауэра*)
- •§ 56. Методы наблюдения и регистрации радиоактивных излучений и частиц
- •§ 57. Ядерные реакции и их основные типы
- •§ 59. Открытие нейтрона. Ядерные реакции под действием нейтронов
- •§ 60. Реакция деления ядра
- •§ 61. Цепная реакция деления
- •§ 62. Понятие о ядерной энергетике
- •§ 63. Реакция синтеза атомных ядер. Проблема управляемых термоядерных реакций
- •§ 64. Космическое излучение
- •§ 65. Мюоны и их свойства
- •§ 66. Мезоны и их свойства
- •§ 67. Типы взаимодействий элементарных частиц
- •§ 68. Частицы и античастицы
- •§ 69. Гипероны. Странность и четность элементарных частиц
- •§ 70. Классификация элементарных частиц. Кварки
Основные уравнения модели идеального газа
Русский
ученый Д. И. Менделеев (1834—1907) объединил
уравнение Клапейрона с законом Авогадро,
отнеся уравнение (42.3) к одному молю,
использовав молярный объем Vm.
Согласно закону Авогадро, при одинаковых
р
и Т
моли всех газов занимают одинаковый
молярный объем Vm,
поэтому постоянная В
будет одинаковой
для всех газов.
Эта общая для всех газов постоянная
обозначается R
и называется
молярном
газовой постоянной. Уравнению
![]() удовлетворяет лишь идеальный газ, и оно
является
уравнением
состояния идеального газа,
называемым также
уравнением
Клапейрона — Менделеева.
удовлетворяет лишь идеальный газ, и оно
является
уравнением
состояния идеального газа,
называемым также
уравнением
Клапейрона — Менделеева.
Основное уравнение молекулярно-кинетической теории идеальных газов
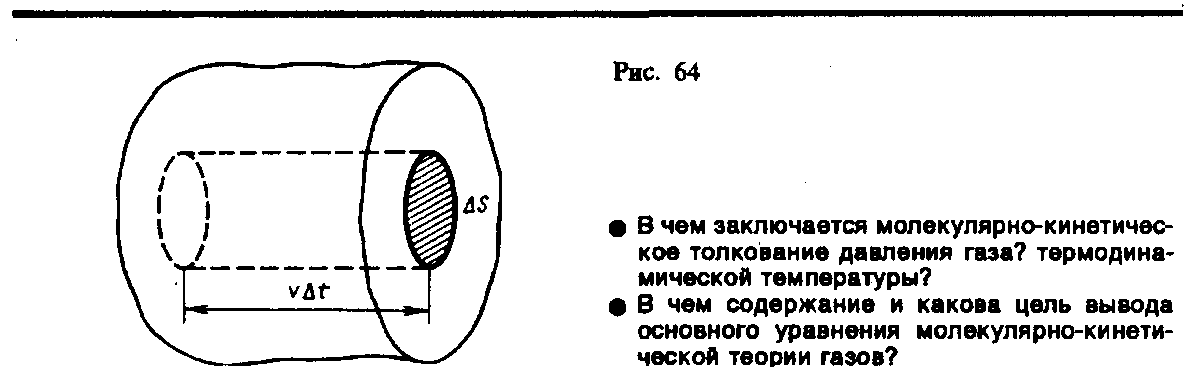
Для вывода основного уравнения молекулярно-кинетической теории рассмотрим одноатомный идеальный газ. Предположим, что молекулы газа движутся хаотически, число взаимных столкновений между молекулами газа пренебрежимо мало по сравнению с числом ударов о стенки сосуда, а соударения молекул со стенками сосуда абсолютно упругие. Выделим на стенке сосуда некоторую элементарную площадку S (рис. 64) и вычислим давление, оказываемое на эту площадку. При каждом соударении молекула, движущаяся перпендикулярно площадке, передает ей импульс m0v – (– m0v) = 2m0v, где m0 — масса молекулы, v — ее скорость. За время t площадки S достигнут только те молекулы, которые заключены в объеме цилиндра с основанием S и высотой vt (рис. 64). Число этих молекул равно nSvt (n — концентрация молекул).
Необходимо, однако, учитывать, что реально молекулы движутся к площадке S под разными углами и имеют различные скорости, причем скорость молекул при каждом соударении меняется. Для упрощения расчетов хаотическое движение молекул заменяют движением вдоль трех взаимно перпендикулярных направлений, так что в любой момент времени вдоль каждого из них движется 1/3 молекул, причем половина молекул 1/6 движется вдоль данного направления в одну сторону, половина — в противоположную. Тогда число ударов молекул, движущихся в заданном направлении, о площадку S будет 1/6nSvt. При столкновении с площадкой эти молекулы передадут ей импульс
![]()
Тогда давление газа, оказываемое им на стенку сосуда,
![]() (43.1)
(43.1)
Если газ в объеме V содержит N молекул, движущихся со скоростями v1, v2, ..., vN, то целесообразно рассматривать среднюю квадратную скорость
![]() (43.2)
(43.2)
характеризующую всю совокупность молекул газа.
Уравнение (43.1) с учетом (43.2) примет вид
![]() (43.3)
(43.3)
Выражение (43.3) называется основным уравнением молекулярно-кинетической теории идеальных газов. Точный расчет с учетом движения молекул по всевозможным направлениям дает ту же формулу.
Учитывая, что n =N / V, получим
![]() (43.4)
(43.4)
или
![]() (43.5)
(43.5)
где Е — суммарная кинетическая энергия поступательного движения всех молекул газа.
Так как масса газа m=Nm0, то уравнение (43.4) можно переписать в виде
![]()
Для одного моля газа т=М (М — молярная масса), поэтому
![]()
где Vm — молярный объем. С другой стороны, по уравнению Клапейрона — Менделеева, pVm=RT. Таким образом,
![]()
откуда
![]() (43.6)
(43.6)
Так как M=m0NА, где т0 — масса одной молекулы, a NА — постоянная Авогадро, то из уравнения (43.6) следует, что
![]() (43.7)
(43.7)
где k=R/NА — постоянная Больцмана. Отсюда найдем, что при комнатной температуре молекулы кислорода имеют среднюю квадратичную скорость 480 м/с, водорода — 1900 м/с. При температуре жидкого гелия те же скорости будут соответственно 40 и 160 м/с.
Средняя кинетическая энергия поступательного движения одной молекулы идеального газа
![]() (43.8)
(43.8)
(использовали формулы (43.5) и (43.7)) пропорциональна термодинамической температуре и зависит только от нее. Из этого уравнения следует, что при Т=0 <0>=0, т. е. при 0К прекращается поступательное движение молекул газа, а следовательно, его давление равно нулю. Таким образом, термодинамическая температура является мерой средней кинетической энергии поступательного движения молекул идеального газа, и формула (43.8) раскрывает молекулярно-кинетическое толкование температуры.
