
- •1.Литературный обзор
- •1.1 Общая характеристика акридона
- •1.2 Синтез акридонов
- •1.3 Применение акридона и его производных
- •1.4 Применение и общая характеристика тионилхлорида
- •2. Экспериментальная часть
- •2.1 Используемые методы анализа и контроля
- •2.2 Синтез тиазольных эфиров из хлорангидридов карбоксиакридонов
- •2.3 Анализ полученного продукта методом ик-спектроскопии
- •2.4 Анализ полученного продукта методом уф-спектроскопии (видимые области спектра)
- •2.5 Анализ полученного продукта методом тсх
- •3. Результаты эксперимента и их обсуждения
- •3.1 Синтез хлорангидрида 2-карбоксиакридона
- •3.2 Синтез 2-(4-метил-1,3-тиазол-5-ил)этилового эфира 2- карбоксиакридона
2.4 Анализ полученного продукта методом уф-спектроскопии (видимые области спектра)
Работали на УФ спектрометре Shimadzu марки UV-800. Готовили стандартный раствор, растворяли полученные тиазольные эфиры в карбиноле до полного растворения. Фотометрирование раствора проводили в кварцевых кюветах толщиной 1 см относительно карбинола в области 800-190 нм.
Для построения калибровочной кривой использовали значения оптической плотности при 362 нм (Аbs 3,85).
2.5 Анализ полученного продукта методом тсх
На хроматографической пластинке аккуратно (чтобы не повредить слой сорбента) на расстоянии 1,5 – 2 см от нижнего края простым карандашом проводят стартовую линию. На стартовую линию наносят тонким капилляром анализируемую пробу. Диаметр пятна не должен превышать 5-6 мм. На расстоянии 1,5 – 2 см от анализируемой пробы наносят пробы свидетелей. Расстояние между ними должно быть не менее 1 см. После нанесения каждой пробы пластинку подсушивают. Пластинку с нанесенными на нее пробой и свидетелями помещают в камеру для хроматографирования, для анализируемого продукта использовали элюент: толуол, ацетон, этанол в соотношении 10:3:5. Нижний край ее погружают в растворитель не более чем на 5 мм. Пластинку высушивают и отмечают линию фронта. Рассчитывают значения Rf.
3. Результаты эксперимента и их обсуждения
3.1 Синтез хлорангидрида 2-карбоксиакридона
Тионилхлорид нельзя использовать на прямую для синтеза тиазольных эфиров, так как нужна кислая среда (тиазольные формы разрушаются), поэтому нами был выбран путь синтез целевого соединения через хлорангидрид. Для этого использовали 5 г. 2-карбоксиакридона и 15 мл. тионилхлорида, таким образом хлористый тионил выступает а качестве реагента и в качестве растворителя. Наблюдали интенсивное выделение SO2 и HCI.(уравнение 4).

(4)
Поскольку хлорангидрид карбоновых кислот частично или полностью подвергается гидролизу, поэтому хлорангидрид в хроматографической пробе превращали в тиазольный эфир 2-карбоксиакридона. Ход реакции контролировали тонкослойной хроматографией. Для этого из реакционной смеси выделенную пробу растворили в бутаноле и наносили на хроматографическую пластинку. В качестве эталона использовали готовый бутиловый эфир 2-карбоксиакридон. В ходе реакции наблюдали одно пятно соответствующее бутиловому эфиру 2-карбоксиакридона.
По окончании реакции избыток тионилхлорида удаляли при атмосферном давлении 50-60%, а остальное в вакууме водоструйного насоса. Уже сухой, измельченный хлорангидрид выдерживали в вакууме водоструйного насоса для удаления SO2 и HCI. Хлорангидрид прелставляет собой твердое вещество коричневого цвета. Он был использован нами без дополнительной очистки .
3.2 Синтез 2-(4-метил-1,3-тиазол-5-ил)этилового эфира 2- карбоксиакридона
Рисунок 1.Тиазольный спирт
Для полного взаимодействия хлорангидрида 2-карбоксиакридона и тиазольного спирта (рисунок 1) в качестве акцептора выступает сам тиазольный спирт, а растворителем является избыток спирта. Целевой эфир получается в виде гидрохлорида.(уравнение 5).

(5)
Реакционную смесь по окончании реакции контролировали методом тонкослойной хроматографии. Полученный продукт обработали раствором соды, обработали раствором соды, промыли водой, сушили. Тиазольные эфиры представляют собой твердое вещество коричнево-зеленое цвета.
Структура полученного нами эфира подтверждена методами ИК, УФ-спектроскопиии хромато-масс-спектрометрии. В масс-спектре полученного продукта (рисунок 2) зарегистрирован пик молекулярного иона (М+, m/z) 365, соответствующий брутто-составу C14H9NO3, что подтверждает образование 2-(4-метил-1,3-тиазол-5-ил)этилового эфира 2- карбоксиакридона (Приложение А).
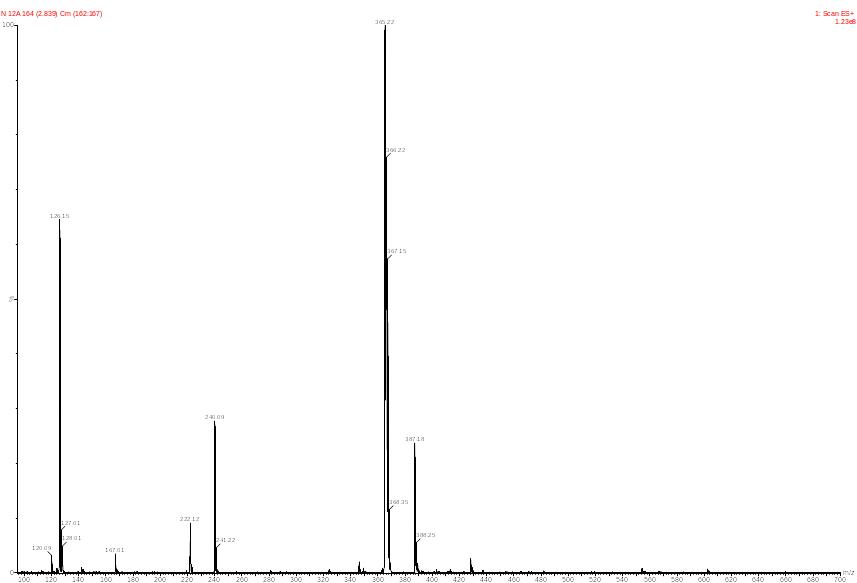
Рисунок 2.Масс-спектр 2-(4-метил-1,3-тиазол-5-ил)этилового эфира 2- карбоксиакридона
Заключение
Проведен анализ литературных данных относительно направлений использования акридона и его производных.
Провели синтез синтез тиазольного эфира 2-карбоксиакридона
Чистота полученного вещества подтверждена методом ТСХ, структура-методами ИК-спектроскопии, УФ-спектрофотометрииихромато-масс-спектрометрии.
Литература
Агрономов А.Е. Избранные главы по органической химии. [Текст]/ А.Е. Аграномов.-М.: Химия, 1990.-560 с.
Беккер Г. Органикум. Практикум по органической химии. Том 2.[Текст] / Г.Беккер, Пер. с нем. под ред. В. М. Потопова, С. В. Пономарева.-М.: Мир,1979.-С.76-78.
Беликов В.Г. Фармацевтическая химия. Часть 1. [Текст]/ В.Г. Беликов.-М.:Высшая школа,1993.-432 с.
Джилкрист Т. Химия гетероциклических соединений. [Текст]/ Т. Джилкрист, Пер. с англ. под ред. М. А. Юровской.-М.:Мир, 1996.-С.455.
Вацуро К.В., Мищенко Г.Л. Синтетические методы органической химии [Текст]/ К.В. Вацуро, Г.Л. Мищенко. -М.: Мир, 1982. –С. 36-43.
Кибардин С.А. Тонкослойная хроматография в органической химии [Текст]/ С.А Кибардин – М.: Химия, 1978. – С.128
Шибнев В.А. Синтез акридиновых производных гидразидов аминокислот и их противомалярийная активность [Текст]/ В.А Шибнев– М:Мир,1995-С.1569
Кнунянц Л. И. Успехи органической химии. Том 1. [Текст]/ И.Л. Кнунянц. – М.: Издательство иностр. литературы. 1963. – 399 с.
Ляхов С.А., Литвинова Л.А., Сувейздис Я.И., Андронати С.А., Рыбалко С.Л., Дядюн С.Т. Интерферониндуцирующие свойства моно- и бис-акридинов [Текст]// -Хим.-фарм. журн. М., 2000. – С. 20 – 21.
Ляхова Е.А. Синтез и ДНК-связывающие свойства акридинил-гидразидовN,N'-диалкилглицинов[Текст]/Е.А Ляхова, С.А. Ляхов, Л.А. Литвинова, З.М. Топилова, И.В. Вельчева, А.И. Трень ,М.Н. Лебедюк, В.П. Федорчук, Г.А. Хорохорена //Хим.-фарм. журнал.-Т.37, №4-2003.-C.12-18.
Пат. 2070438 РоссийскаяФедирация. Адсорбционно-бактерицидный углеродный материал и способ его изготовленияПименов А.В.; Либерман А.И.; Шмидт Д.Л. Заявитель и патентообладатель Совместное российско-американское предприятие - Акционерное общество закрытого типа "Аквафор"; заявл. 04.07.1994
Сайкс П. Механизмы реакций в органической химии. [Текст]/ П. Сайкс.- М.: Химия,1977.-320 с.
Степанов Б. И. Введение в химию и технологию органических красителей. Учебное пособие для вузов. [Текст]/ Б. И. Степанов.-М.: Химия, 1984.-С.592.
Физер Л. Реагенты для органического синтеза, Т.3 [Текст] / Л. Физер, М. Физер, Пер. с англ. Под ред. И. Л. Кнунянца, М.: Мир, 1970. – 477 с.
ЭльдерфилдР. Гетероциклические соединения [Текст]/ Р. Эльдерфилд. –М. : Изд-во иностранной литературы, 1995. –С.373-424.
Приложения
