
- •I.Теоретические вопросы требующие развернутого ответа
- •3.Основные типы кристаллических решеток металлов : оцк, гцк, гп.Их параметры.
- •5.Дефекты кристаллического строения реальных металлов : точечные , линейные , поверхностные и объемные.Их роль в формировании свойств металлов .
- •7.Кристаллизация металлов : несамопроизвольная кристаллизация , строение литого металла .Способы управления процессом кристаллизации.
- •8.Строение металлических сплавов .Понятия : сплав , термодинамическая система , компонент , фаза.
- •9.Твердые растворы замещения : определение , типы тр замещения , условия их образования , примеры.
- •10.Твердые растворы внедрения : условия образования , примеры.
- •11.Химические соединения : определение , условия образования , примеры.
- •12.Правило фаз Гиббса. Диаграмма состояния двухкомпонентных систем. Ликвидус и солидус.
- •15.Диаграмма фазового равновесия с нерастворимостью компонентов в твердом состоянии и эвтектикой. Типы образующихся структур.
- •Диаграмма состояния сплавов с отсутствием растворимости компонентов в компонентов в твердом состоянии (механические смеси)
- •16.Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии и эвтектикой. Предельная растворимость , линия сольвус. Типы образующихся структур.
- •Диаграмма состояния сплавов с ограниченной растворимостью компонентов в твердом состоянии
- •17.Диаграмма состояния системы с образованием устойчивого химического соединения . Диаграмма состояния сплавов, компоненты которых образуют химические соединения.
- •18.Свойства железа , углерода , полиморфизм , критические точки .Взаимодействие железа с углеродом.
- •19.Фазы и структурные составляющие сплавов Fe-c (Fe3c) : определения , характеристики свойства.
- •20.Диаграмма фазового равновесия железо-углерод : реакции равновесия в системе. Диаграмма состояния железо—углерод (Fe—с)
- •24.Термическая обработка металлов и сплавов .Классификация видов термической обработки.
- •25.Способы отжига сталей : полный и неполный отжиг , нормализация.
- •26.Способы отжига сталей : гомогенизирующий , сфероидизирующий отжиг. Суть режимы.
- •28.Превращения , происходящие при нагреве сталей до аустенитного состояния. Понятие о китических точках сталей Ac1 , Ac3 , Acm , Ar1 , Ar3 ,Arm.
- •1. Превращение перлита в аустетит
- •29.Закалка сталей-полная и неполная . Понятие о критической скорости закалки .Закалка сталей на мартенсит.
- •30.Превращения происходящие при охлаждении сталей : промежуточное (бейнитное) превращение , особенности , структура. Бейнитное превращение Строение бейнита
- •Участок диаграммы состояния Fe — с
- •31.Превращения происходящие при отпуске закаленной стали. Низкий , средний и высокий отпуск : режимы, структура стали после отпуска.
- •32.Химико-термическая обработка . Общие закономерности хто.
- •Химико-термическая обработка стали
- •33.Цементация сталей : сущность , температурные режимы , структура после цементации.
- •35. Нитроцементация: сущность, температурные режимы, структура поверхности стали после нитроцементации.
- •36. Углеродистые стали. Влияние углерода и примесей на свойства стали.
- •38. Конструкционные углеродистые стали обыкновенного качества: классификация, маркировка, применение.
- •Стали конструкционные углеродистые обыкновенного качества
- •Стали группы а
- •Стали группы б
- •Стали группы в
- •Маркировка
- •Применение
- •39.Качественные конструкционные углеродистые стали : классификация , маркировка , применение.
- •40.Чугуны.Маркировка чугунов.
- •41. Классификация по назначению и маркировка легированных сталей. Примеры.
- •42.Легированные стали. Влияние легирующих элементов на структуру и свойства сталей. Карбиды в легированных сталях.
- •43.Легированные стали : подшипниковые стали : принцип легирования , маркировка , термообработка . Подшипниковые стали
- •44.Легированные стали : высокопрочные легированные стали : принципы легирования , термообработка.
- •45.Легированные стали : стали для строительных конструкций , принцип легирования , маркировка термообработка.
- •46.Легированные стали : улучшаемые стали , принцип легирования , маркировка , термообработка.
9.Твердые растворы замещения : определение , типы тр замещения , условия их образования , примеры.
Атомы растворенного элемента B размещаются в кристаллической решетке растворителя-элемента A , замещая атомы в узлах решетки- такой раствор называется Твердым раствором замаещения.Колличество замещенных атомов , так же как и количество внедреных , может изменятся в широких пределах , что и приводит к переменной растворимости твердых растворов. По степеням растворимости компонентов различают твердые растворы:1)с неограниченной растворимостью компонентов; 2)с ограниченной растворимостью компонентов. Неограниченная растворимость - это когда при любом количественном соотношении сплавляемых элементов все разнородные атомы размещаются в узлах общей пространственной решетки. Ограниченная раствориость- когда растворяется только определенная часть растворяемого вещества в растворителе.Неограниченная растворимость наблюдается в сплавах Cu-Au ; Cu-Ni; Ge-Si.
10.Твердые растворы внедрения : условия образования , примеры.
Твердые растворы внедрения образуются внедрением атомов растворенного компонента в поры кристаллической решетки растворителя (рисунок, позиция б). Образование таких растворов, возможно, если атомы растворенного элемента имеют малые размеры. Такими являются элементы, находящиеся в начале периодической системы Менделеева, углерод, водород, азот, бор. Размеры атомов превышают размеры межатомных промежутков в кристаллической решетке металла, это вызывает искажение решетки и в ней возникают напряжения. Концентрация таких растворов не превышает 2-2.5%.Главное условие образования этих растворов , что бы атомные радиусы растворителя отличались от атомных радиусов растворяемого вещества не более , чем на 15%.Примером твердого раствора внедрения является твердые растворы углерода в Fe(гамма) и Fe(альфа).
11.Химические соединения : определение , условия образования , примеры.
Х имическое
соединение-
однородное кристаллическое тело ,
имеющее собственную решетку у упорядоченным
расположением в ней атомов компонентов
и специфические свойства , отличные от
решеток и свойств исходный компонентов.
Сплавы химических
соединений
образуются между элементами, значительно
различающимися по строению и свойствам,
если сила взаимодействия между
разнородными атомами больше, чем между
однородными.
Особенности
этих сплавов: 1)Постоянство
состава, то есть сплав образуется при
определенном соотношении компонентов,
химическое соединение обозначается Аn
Вm/ 2)Образуется
специфмческая, отличающаяся от решеток
элементов, составляющих химическое
соединение, кристаллическая решетка с
правильным упорядоченным расположением
атомов 3)Ярко
выраженные индивидуальные свойства
4)Постоянство
температуры кристаллизации, как у чистых
компонентов
имическое
соединение-
однородное кристаллическое тело ,
имеющее собственную решетку у упорядоченным
расположением в ней атомов компонентов
и специфические свойства , отличные от
решеток и свойств исходный компонентов.
Сплавы химических
соединений
образуются между элементами, значительно
различающимися по строению и свойствам,
если сила взаимодействия между
разнородными атомами больше, чем между
однородными.
Особенности
этих сплавов: 1)Постоянство
состава, то есть сплав образуется при
определенном соотношении компонентов,
химическое соединение обозначается Аn
Вm/ 2)Образуется
специфмческая, отличающаяся от решеток
элементов, составляющих химическое
соединение, кристаллическая решетка с
правильным упорядоченным расположением
атомов 3)Ярко
выраженные индивидуальные свойства
4)Постоянство
температуры кристаллизации, как у чистых
компонентов
<-----------------------------------------------------------------------------------------Рис. 4.2. Кристаллическая решетка химического соединения
Примером химического соединения может служить : Mg4Ca3
12.Правило фаз Гиббса. Диаграмма состояния двухкомпонентных систем. Ликвидус и солидус.
Правило фаз Гиббса Правило фаз записывается следующим образом:
![]() где
j — число фаз
(например, агрегатных
состояний
вещества);v — число степеней
свободы,
то есть независимых параметров
(температура, давление, концентрация
компонентов), которые полностью определяют
состояние системы при равновесии и
которые можно менять без изменения
числа и природы фаз;k — число компонентов
системы — число входящих в систему
индивидуальных веществ за вычетом числа
химических уравнений, связывающих эти
вещества. Иначе говоря, это минимальное
количество веществ, из которых можно
приготовить каждую фазу системы.n —
число переменных, характеризующих
влияние внешних условий на равновесие
системы.При переменных давлении и
температуре правило фаз сводится к
выражению:
где
j — число фаз
(например, агрегатных
состояний
вещества);v — число степеней
свободы,
то есть независимых параметров
(температура, давление, концентрация
компонентов), которые полностью определяют
состояние системы при равновесии и
которые можно менять без изменения
числа и природы фаз;k — число компонентов
системы — число входящих в систему
индивидуальных веществ за вычетом числа
химических уравнений, связывающих эти
вещества. Иначе говоря, это минимальное
количество веществ, из которых можно
приготовить каждую фазу системы.n —
число переменных, характеризующих
влияние внешних условий на равновесие
системы.При переменных давлении и
температуре правило фаз сводится к
выражению:
![]()
В случае однокомпонентной системы оно упрощается до:
![]() ,
,
Отсюда
видно, например, что в однокомпонентной
системе три фазы (j=3) могут сосуществовать
при числе степеней свободы v, равном
нулю, то есть при фиксированных давлении
и температуре, что соответствует тройной
точке
на фазовой диаграмме. Две фазы (j=2)
сосуществуют при произвольном измененнии
либо давления, либо температуры, когда
вторая из этих переменных не является
независимой (v=1), то есть двухфазному
равновесию на фазовой диаграмме
соответствует линия. Если фаза одна
(j=1), число степеней свободы системы
равно двум, то есть температура и давление
могут менятся независимо в пределах
некоторой области на фазовой диаграмме —
пока система не окажется на одной из
линий двухфазного равновесия.Иногда
правило фаз записывают следующим
образом:
![]()
то есть при равновесии число фаз в системе меньше либо равно числу компонентов плюс 2.
Диаграмма состояния двухкомпонентных систем :
Компонент - (от латинского "составляющий") составная часть смеси веществ. Состав двухкомпонетной системы графически изображают с помощью отрезка состава (рис. 12.1). Если отрезок прямой АВ рассматривать как выражение состава системы компонентов А и В, то точка А соответсвует 100% этого компонента, а точка В - 100% компонента В. Любая точка отрезка АВ будет отвечать смеси этих компонентов.
 Рис.
12.1.
Рис.
12.1.
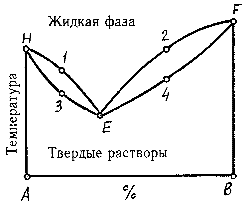 Рис.
12.2.
Рис.
12.2.
Таким образом, точка К этого отрезка будет отвечать составу с содержанием 40% компонента В и 60% компонента А. Длину отрезка принимают равной 10 см. Диаграмма "состав-свойство" показывает изменение какого-либо свойства системы в зависимости от ее состава. На рис. 12.2 приведена плоская диаграмма "состав-свойство" для двухкомпонентной системы. На перпендикулярах к отрезку АВ, выражающему состав системы, отложены температуры раствора в градусах. Кривая H1E2F - линия ликвидуса, изображает начало процесса кристаллизации раствора в твердую фазу. Кривая H3E4F - линия солидуса, изображает конец процесса кристаллизации раствора в твердую фазу. Область между кривыми H1E2F и H3E4F - двухфазное состояние, в котором выделяются кристаллы компонентов А и В, находясь в равновесии с жидкой фазой. Ниже кривой H3E4F система находится в твердом состоянии. Точка Е (эвтектическая точка или эвтектика) - точка одновременной кристаллизации двух компонентов (для двухкомпонентной системы - двойная эвтектика).
Ликвидус и солидус : Верхняя кривая называется кривой ликвидус, она соответствует началу кристаллизации. Выше этой кривой все сплавы находятся в жидком состоянии. Область существования жидкого раствора обозначим буквой L (от греч. ликва– жидкость). Нижняя кривая называется кривой солидус, она соответствует концу кристаллизации и ниже нее все сплавы находятся в твердом состоянии. Обозначим область существования твердого раствора a . В интервале между кривыми ликвидуса и солидуса, называемом интервалом кристаллизации, все сплавы будут находиться в двухфазном состоянии (L + a).
Солидус- геометрическое место всех точек определяющих температуру конца кристаллизации. |
|
13.Диаграмма состояния системы , компоненты которых неограниченно растворяются как в жидком , так и в твердом состоянии . Типы образующихся структур.
Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии (сплавы твердые растворы с неограниченной растворимостью)
Диаграмма состояния и кривые охлаждения сплавов системы представлены на рис. 5.1.
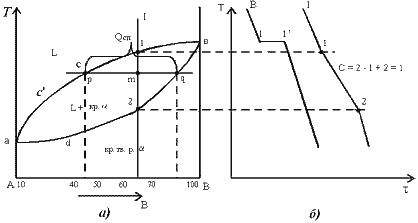
Рис.5.1 Диаграмма состояния сплавов с неограниченной растворимостью компонентов в твердом состоянии (а); кривые охлаждения типичных сплавов (б)
Сначала
получают термические кривые. Полученные
точки переносят на диаграмму, соединив
точки начала кристаллизации сплавов и
точки конца кристаллизации, получают
диаграмму состояния.Проведем анализ
полученной диаграммы: 1. Количество
компонентов: К = 2 (компоненты А и В).2.
Число фаз: f = 2 (жидкая фаза L, кристаллы
твердого раствора
![]() )3.
Основные линии диаграммы: 1)acb – линия
ликвидус, выше этой линии сплавы находятся
в жидком состоянии; 2)adb – линия солидус,
ниже этой линии сплавы находятся в
твердом состоянии.
)3.
Основные линии диаграммы: 1)acb – линия
ликвидус, выше этой линии сплавы находятся
в жидком состоянии; 2)adb – линия солидус,
ниже этой линии сплавы находятся в
твердом состоянии.
4.
Характерные сплавы системы: Чистые
компоненты А и В кристаллизуются при
постоянной температуре, кривая охлаждения
компонента В представлена на рис. 5.1,б.
Остальные сплавы кристаллизуются
аналогично сплаву I, кривая охлаждения
которого представлена на рис. 5.1, б.
Процесс
кристаллизации сплава I:
до точки 1 охлаждается сплав в жидком
состоянии. При температуре, соответствующей
точке 1, начинают образовываться центры
кристаллизации твердого раствора
.
На кривой охлаждения отмечается перегиб
(критическая точка), связанный с
уменьшением скорости охлаждения
вследствие выделения скрытой теплоты
кристаллизации. На участке 1–2 идет
процесс кристаллизации, протекающий
при понижающейся температуре, так как
согласно правилу фаз в двухкомпонентной
системе при наличии двух фаз (жидкой и
кристаллов твердого раствора
)
число степеней свободы будет равно
единице
![]() .
При достижении температуры соответствующей
точке 2, сплав затвердевает, при дальнейшем
понижении температуры охлаждается
сплав в твердом состоянии, состоящий
из однородных кристаллов твердого
раствора
.
.
При достижении температуры соответствующей
точке 2, сплав затвердевает, при дальнейшем
понижении температуры охлаждается
сплав в твердом состоянии, состоящий
из однородных кристаллов твердого
раствора
.
14.Конода и ее значение для анализа процесса кристаллизации сплавов . Дендритная ( внутризеренная ) ликвация.
Коноды наносят на диаграммы на основании экспериментальных определений; точки пересечения коноды с линией ликвидуса и солидуса или с линиями растворимости показывают соответственно состав и количество фаз ( например, жидкой и твердой для линии ликвидуса и солидуса), находящихся в равновесии в сплаве данного состава при данной температуре. Сплавы, находящиеся в остальных точках коноды, имеют одинаковый фазовый состав, но разное количественное соотношение фаз. Конода- линия соединяющая составы фаз , находящихся в равновесии. Ликвация(неоднородность химического состава, возникающая при кристаллизации) — неоднородность сплава по химич. составу, структуре или неметаллич. включениям, возникающая при кристаллизации. Она бывает микро-, макро- и местной. К первой и относят дендритную ликвацию, по сути – внутрикристаллическую. Дендритная ликвация проявляется в микрообъемах сплава, близких к размеру зерен. Дендритная ликвация может быть ослаблена продолжительным нагревом затвердевшего сплава при температурах, обеспечивающих достаточную скорость диффузии (несколько ниже солидуса). После такого нагрева, называемого диффузионным отжигом или гомогенизацией, дендритная структура литого сплава уже не выявляется и сплав состоит из однородных кристаллов твердого раствора. Дендритная ликвация понижает пластичность и вязкость легированной стали. Поэтому слитки и крупные отливки нередко подвергают гомогенизирующему или диффузионному отжигу. Нагрев при диффузионном отжиге должен быть до высоких температур 1100-1200°С, так как только в этом случае более полно протекают диффузионные процессы, необходимые для выравнивания в отдельных объемах состава стали. Диффузия наиболее интенсивно протекает в начале выдержки, заметно снижаясь с течением времени. Поэтому во избежание образования большого количества окалины, уменьшения расхода топлива и увеличения производительности печей выдержка должна быть минимальной, обычно 15-20 ч. После выдержки садку охлаждают до 800-820°С в печи, а далее на воздухе.

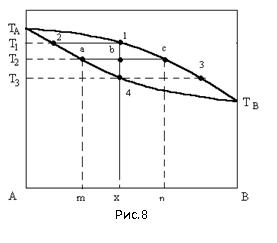 Ликвидус-
геометрическое место всех точек
определяющих температуру начала
кристаллизации.
Ликвидус-
геометрическое место всех точек
определяющих температуру начала
кристаллизации.