- •Теория химического строения органических соединений а.М. Бутлерова
- •3/ Классификация органических соединений
- •4. Механизмы органических реакций
- •Мнемоническое правило
- •6. Гомологические ряды органических соединений
- •7. Предельные углеводороды (алканы). Номенклатура алканов и их производных
- •8. Непредельные углеводороды ряда этилен. Физические свойства
- •Методы получения алкенов
- •Дегидрогалогенирование и дегалогенирование алканов
- •Гидрирование алкинов
- •Химические свойства
- •Окисление
- •Реакции полимеризации
- •Физические свойства некоторых диеновых углеводородов
- •11. Ароматические углеводороды (арены)
- •15. Многоатомные спирты
- •16. Фенолы
- •17/ Альдегиды и их химические свойства
- •18. Одноосновные карбоновые кислоты
- •19. Сложные эфиры
- •20/ Аминокислоты
- •21/ Азотсодержащие гетероциклические соединения. Пиридин
- •22/ Строение полимеров, свойства и синтез полимеров
- •Высокомолекулярные соединения
- •24. Масс-спектрометрия
- •Раздел 2. Электронная уф спектроскопия
- •Раздел 3. Колебательная ик спектроскопия
- •Раздел 4. Спектроскопия ядерного магнитного резонанса
- •25. Амины
11. Ароматические углеводороды (арены)
Ароматическими углеводородами (аренами) называются вещества, в молекулах которых содержится одно или несколько бензольных колец — циклических групп атомов углерода с особым характером связей.
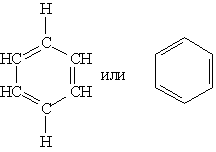
Эта формула правильно отражает равноценность шести атомов углерода, однако не объясняет ряд особых свойств бензола. Например, несмотря на ненасыщенность, бензол не проявляет склонности к реакциям присоединения: он не обесцвечивает бромную воду и раствор перманганата калия, т. е. не дает типичных для непредельных соединений качественных реакций.
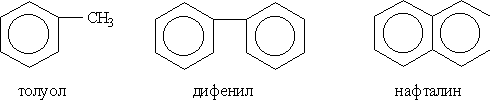
Номенклатура и изомерия. Условно арены можно разделить на два ряда. К первому относят производные бензола (например, толуол или дифенил), ко второму — конденсированные (полиядерные) арены (простейший из них — нафталин):
Гомологический ряд бензола отвечает общей формуле С6Н2n-6.
Структурная изомерия в гомологическом ряду бензола обусловлена взаимным расположением заместителей в ядре. Монозамещенные производные бензола не имеют изомеров положения, так как все атомы в бензольном ядре равноценны. Дизамещенные производные существуют в виде трех изомеров,

различающихся взаимным расположением заместителей. Положение заместителей указывают цифрами или приставками: орто- (о-), мета- (м-), пара- (п-).
Радикалы ароматических углеводородов называют арильными радикалами. Радикал С6Н5 — называется фенил.
Физические свойства. Первые члены гомологического ряда бензола (например, толуол, этилбензол и др.) — бесцветные жидкости со специфическим запахом. Они легче воды и нерастворимы в ней. Хорошо растворяются в органических растворителях. Бензол и его гомологи сами являются хорошими растворителями для многих органических веществ. Все арены горят коптящим пламенем ввиду высокого содержания углерода в их молекулах.
Способы получения.
1. Получение из алифатических углеводородов. При пропускании алканов с неразветвленной цепью, имеющих не менее шести атомов углерода в молекуле, над нагретой платиной или оксидом хрома происходит дегидроциклизация — образование арена с выделением водорода:
![]()
2. Дегидрирование циклоалканов. Реакция происходит при пропускании паров циклогексана и его гомологов над нагретой платиной:
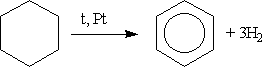
3. Получение бензола тримеризацией ацетилена.
4. Получение гомологов бензола по реакции Фриделя—Крафтса (см. далее).
5. Сплавление солей ароматических кислот со щелочью:
![]()
Химические свойства. Обладая подвижной шестеркой -электронов, ароматическое ядро является удобным объектом для атаки электрофильными реагентами. Этому способствует также пространственное расположение -электронного облака с двух сторон плоского -скелета молекулы (см. рис. б).
Для аренов наиболее характерны реакции, протекающие по механизму электрофильного замещения, обозначаемого символом SE (от англ. substitution electrophilic).
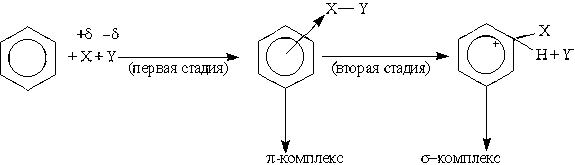
Механизм электрофильного замещения можно представить следующим образом. Электрофильный реагент XY (X является электрофилом) атакует электронное облако, и за счет слабого электростатического взаимодействия образуется неустойчивый -комплекс. Ароматическая система при этом еще не нарушается. Эта стадия протекает быстро. На второй, более медленной стадии формируется ковалентная связь между электрофилом Х и одним из атомов углерода кольца за счет двух -электронов кольца. Этот атом углерода переходит из sр2- в sр3-гибридное состояние. Ароматичность системы при этом нарушается. Четыре оставшиеся -электрона распределяются между пятью другими атомами углерода, и молекула бензола образует карбокатион, или -комплекс.
Нарушение ароматичности энергетически невыгодно, поэтому структура -комплекса менее устойчива, чем ароматическая структура. Для восстановления ароматичности происходит отщепление протона от атома углерода, связанного с электрофилом (третья стадия). При этом два электрона возвращаются в -систему и тем самым восстанавливается ароматичность:

Реакции электрофильного замещения широко используются для синтеза многих производных бензола.
Химические свойства бензола. 1. Галогенирование. Бензол не взаимодействует с хлором или бромом в обычных условиях. Реакция может протекать только в присутствии катализаторов — безводных АlСl3, FeСl3, АlВr3. В результате реакции образуются галогенозамещенные арены:

Роль катализатора заключается в поляризации нейтральной молекулы галогена с образованием из нее электрофильной частицы:
![]()
2. Нитрование. Бензол очень медленно реагирует с концентрированной азотной кислотой даже при сильном нагревании. Однако при действии так называемой нитрующей смеси (смесь концентрированных азотной и серной кислот) реакция нитрования проходит достаточно легко:
![]()
3. Сулъфирование. Реакция легко проходит под действием “дымящей” серной кислоты (олеума):
![]()
4. Алкилирование по Фриделю—Крафтсу. В результате реакции происходит введение в бензольное ядро алкильной группы с получением гомологов бензола. Реакция протекает при действии на бензол галогеналканов RСl в присутствии катализаторов — галогенидов алюминия. Роль катализатора сводится к поляризации молекулы RСl с образованием электрофильной частицы:
![]()
В зависимости от строения радикала в галогеналкане можно получить разные гомологи бензола:
![]()
5. Алкилирование алкенами. Эти реакции широко используются в промышленности для получения этилбензола и изопропилбензола (кумола). Алкилирование проводят в присутствии катализатора АlСl3. Механизм реакции сходен с механизмом предыдущей реакции:
![]()
Все рассмотренные выше реакции протекают по механизму электрофильного замещения SE.
Реакции присоединения к аренам приводят к разрушению ароматической системы и требуют больших затрат энергии, поэтому протекают только в жестких условиях.
6. Гидрирование. Реакция присоединения водорода к аренам идет при нагревании и высоком давлении в присутствии металлических катализаторов (Ni, Pt, Pd). Бензолпревращается в циклогексан, а гомологи бензола — в производные циклогексана:
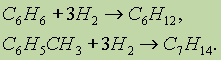
7. Радикальное галогенирование. Взаимодействие паров бензола с хлором протекает по радикальному механизму только под воздействием жесткого ультрафиолетового излучения. При этом бензол присоединяет три молекулы хлора и образует твердый продукт — гексахлорциклогексан (гексахлоран) С6Н6Сl6:
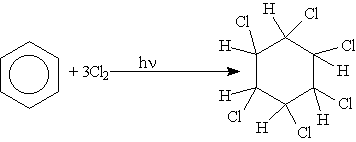
Правила ориентации (замещения) в бензольном кольце.
Важнейшим фактором, определяющим химические свойства молекулы, является распределение в ней электронной плотности. Характер распределения зависит от взаимного влияния атомов.
В молекулах, имеющих только -связи, взаимное влияние атомов осуществляется через индуктивный эффект. В молекулах, представляющих собой сопряженные системы, проявляется действие мезомерного эффекта.
Влияние заместителей, передающееся по сопряженной системе -связей, называется мезомерным (М) эффектом.
В молекуле бензола -электронное облако распределено равномерно по всем атомам углерода за счет сопряжения. Если же в бензольное кольцо ввести какой-нибудь заместитель, это равномерное распределение нарушается и происходит перераспределение электронной плотности в кольце. Место вступления второго заместителя в бензольное кольцо определяется природой уже имеющегося заместителя.
Заместители подразделяют на две группы в зависимости от проявляемого ими эффекта (мезомерного или индуктивного): электронодонорные и электроноакцепторные.
Электронодонорные заместители проявляют +М- и +I-эффект и повышают электронную плотность в сопряженной системе. К ним относятся гидроксильная группа —ОН и аминогруппа —NН2. Неподеленная пара электронов в этих группах вступает в общее сопряжение с -электронной системой бензольного кольца и увеличивает длину сопряженной системы. В результате электронная плотность сосредоточивается в орто- и пара-положениях:

Алкильные группы не могут участвовать в общем сопряжении, но они проявляют +I-эффект, под действием которого происходит аналогичное перераспределение -электронной плотности.
Электроноакцепторные заместители проявляют -М-эффект и снижают электронную плотность в сопряженной системе. К ним относятся нитрогрупла —NO2, сульфогруппа —SO3Н, альдегидная —СНО и карбоксильная —СООН группы. Эти заместители образуют с бензольным кольцом общую сопряженную систему, но общее электронное облако смещается в сторону этих групп. Таким образом, общая электронная плотность в кольце уменьшается, причем меньше всего она уменьшается вмета-положениях:
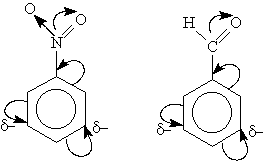
Полностью галогенизированные алкильные радикалы (например, —ССl3) проявляют -I-эффект и также способствуют понижению электронной плотности кольца.
Закономерности преимущественного направления замещения в бензольном кольце называют правилами ориентации.
Заместители, обладающие +I-эффектом или +М-эффектом, способствуют электрофильному замещению в орто- и пара-положениях бензольного кольца и называютсязаместителями (ориентантами) первого рода:
![]()
Заместители, обладающие -I-эффектом или -М-эффектом, направляют электрофильное замещение в мета-положения бензольного кольца и называются заместителями (ориентантами) второго рода:
![]()
Так, толуол, содержащий заместитель первого рода, нитруется и бромируется в пара- и орто-положения:

Нитробензол, содержащий заместитель второго рода, нитруется и бромируется в мета-положение:
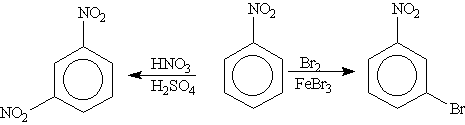
Помимо ориентирующего действия заместители оказывают влияние и на реакционную способность бензольного кольца: ориентанты 1-го рода (кроме галогенов) облегчают вступление второго заместителя; ориентанты 2-го рода (и галогены) затрудняют его.
Применение. Бензол и его гомологи применяются как химическое сырье для производства лекарств, пластмасс, красителей, ядохимикатов и многих других органических веществ. Широко используются как растворители. Бензол в качестве добавки улучшает качество моторного топлива.
12. Галогенопроизводные углеводородов — производные углеводородов, в молекулах которых один или несколько атомов водорода замещены атомами галогенов. Галогенопроизводные углеводородов получают непосредственным взаимодействием углеводородов (как предельных, так и непредельных) с галогенами. Галогенопроизводные углеводородов используются для синтеза многих органических веществ (спиртов, аминов и др.).
Производные углеводородов, в молекулах которых один или несколько атомов водорода замещены атомами галогенов, называют галогенпроизводными углеводородов. Соответственно различают моногалогенопроизводные, в молекулах которых имеется один атом галогена, и полигалогенопроизводные, содержащие несколько атомов галогена. Последние в свою очередь подразделяются на ди-, три-, тетра- и т.д. галогенопроизводные.
Галогенопроизводные классифицируют и по характеру входящих в их молекулы галогенов. Так, различают фторпроизводные, хлорпроизводные, бромпроизводные, иодпроизводные. В практике чаще всего встречаются хлорпроизводные, поскольку хлор наиболее доступен. В последнее время все большее применение находят фторпроизводные. Возможны и смешанные галогенопроизводные, содержащие атомы различных галогенов. В общем, число галогенпроизводных очень велико.
В зависимости от характера углеводорода, производным которого является галогенсодержащие соединение, различают галогенпроизводные предельных и непредельных углеводородов.
2. Галогенпроизводные предельных углеводородов
2.1. Номенклатура.
Исходя из этого отдельные названия галогенпроизводных выводят из прилагательного, образованного из названия соответствующего галогена (хлористый, бромистый, иодистый, фтористый), и из названия радикала. Так, по метану и этану соответствуют, например, следующие галогенпроизводные:
СН3 – Cl хлористый метил (хлорметан)
СН3 – СН2 – Вr бромистый этил (бромэтан)
По международной номенклатуре (правила ЮПАК), для наименования галогенпроизводных используют радикально-функциональные и заместительные названия.
По радикально-функциональной номенклатуре, моногалогенпроизводные называются алкилгалогенидами. Отдельные названия образуют, помещая после наименования углеводородного радикала (алкила) слова – хлорид, бромид, иодид, фторид. Приведенные выше алкилгалогениды называются – метилхлорид, этилбромид.
По заместительной номенклатуре, названия галогенпроизводных образуют из соответствующего его углеродному скелету заместительного названия углеводорода, впереди которого указывают название галогена; если требуется, перед названием галогена ставят цифру, обозначающую номер углеродного атома основы (главной цепи) соединения, при котором расположен галоген. Нумерацию цепи начинают с того конца, к которому ближе атом галогена. Заместительные названия приведенных выше и ниже галогенпроизводных показаны рядом с формулами в скобках:
СН3 – СН2 – СН2 бромистый пропил (1-бромпропан)
Br
СН3 – СН – СН3 бромистый пропил (2-бромпропан)
Br
Радикально-функциональные названия этих соединений: пропилбромид, пропилбромид
2.2. Изомерия.
Начиная с галогенпроизводных пропана (С3Н7X) проявляется изомерия положения галогена в цепи молекулы. В зависимости от того, расположен ли галоген при первичном, вторичном или третичном углеродных атомов, различают первичные, вторичные и третичные галогеналкилы.
У галогенпроизводных бутана (С4Н9X) и следующих за ними галогенпроизводных изомерия положения галогена сочетается с изомерией углеродного скелета. Двум изомерным бутанам соответствуют четыре изомерных галогенпроизводных. Например:
Хлорпроизводные н-бутана:
СН3 – СН2 – СН2 – СН2
Сl
хлористый бутил (1-хлорбутан)
СН3 – СН2 – СН – СН3
Сl
хлористый бутил (2-хлорбутан)
Хлорпроизводные изобутана:
СН3
СН3 – С – СН3
Сl
Трет-хлористый изобутил (2-хлор-2-метилпропан)
Радикально-функциональные названия этих соединений: бутилхлорид, вторбутилхлорид, изобутилхлорид, трет-бутилхлорид. Галогеналкилы с большим числом углеродных атомов имеют еще большее количество изомеров.
Так как в галогенпроизводных, атомы галогена могут быть расположены как при одном и том же, так и при различных углеродных атомов, то это еще больше усложняет изомерию (геминальными и вицинальными, соответственно). Так ниже приведены названия полигалогенпроизводных:
СН2Сl2 – дихлорметан, хлористый метилен;
СНСl3 – трихлорметан, хлороформ;
ССl4 – тетрахлорметан, четыреххлористый углерод;
СН3 – СНСl2 – 1,1-дихлорэтан, хлористый этилиден;
СН2Сl – СН2Cl - 1,2-дихлорэтан, хлористый этилен;
СНСl2 – СН2Сl – 1,1,2-трихлорэтан;
ССl3 – СН3 – 1,1,1-трихлорэтан;
ССl3 – СН2Сl – 1,1,1,2-тетрахлорэтан
2.3. Способы получения.
Галогенпроизводные получают прямым галогенированием углеводородов реакцией замещения, присоединением галогенов и галогенводородов к алкенам и алкинам, из спирта – реакцией с галогенводородами и галогенидами фосфора и серы.
2.3.1.Прямое галогенирование углеводородов.
Таким методом можно получить хлор-, фтор- и бромуглеводороды. Прямое иодирование алканов неизвестно. Методы являются промышленными.
Хлорирование.
Хлор реагирует с предельными углеводородами только под влиянием света или еще лучше УФ-лучами, или температуры .При УФ-облучении смесь метана и хлора может закониться взрывом, поэтому реакцию ведут в избытке алкана в реакторах с УФ-лампами. Реакция протекает по свободнорадикальному механизму, при чем последовательно замещаются хлором все атомы водорода:
СН4 + Cl2 → CH3Cl + HCl → CH2Cl2 + 2HCl → и т.д.
Хлористый Хлористый
метил метилен
Фторирование.
Фтор с алканами реагирует очень энергично, даже со взрывом, так как в реакции выделяется много теплоты, поэтому необходимы специальные условия: разбавление фтора азотом, специальная конструкция реакторов с медными сетками для эффективного отвода теплоты реакции. В качестве переносчиков фтора используют фториды металлов (СоF2.AgF, MnF2). Под действием фтора образуются CoF3, AgF2, MnF4, которые фторируют алканы. Реакция протекает по свободнорадикальному механизму:
СН4 → CH3F + CoF3
Бромирование.
Прямое бромирование для простейших алканов (метан, этан) малохарактерно. В принципе бромирование возможно при нагревании и интенсивном облучении УФ-светом. Для гексана, гептана и других алканов возможно бромирование при кипячении и освещении:
С6Н14 → C6H13Br + HBr
2.3.2.Реакции присоединения к алкеном и алкинам.
Алкены легко присоединяют галогены (F, Cl, Br, I). Очень энергично, даже со взрывом, реагирует F2, нужны специальные условия; медленно реагирует I2.
СН3 – СН = СН2 + НBr CH3 – CHBr – CH3
бромистый пропил
СН3 – СН = СН2 + НСl → СН3 – СН – СН3 Хлористый пропил
Cl
Присоединение галогенов к алкинам происходит медленнее, чем в случае алкенов. Механизм реакции присоединения галогенов к алкинам до конца не выяснен.
СН ≡ СН + Сl2 → Сl – СН = СН – Сl → CHCl2 – CHCl2 1,1,2,2-тетрахлорэтан
1,2-дихлорэтен
Присоединение галогенводородов идет обычно на холоду, этот способ наиболее удобен для получения галогенпроизводных.
2.3.3. Реакции замещения.
Получение галогенпроизводных из спиртов.
Замещение гидроксильной группы на атом галогена в спиртах происходит под действием галогенводородов или галогенидов фосфора и серы. К эффективным реагентам относятся РСl3, POCl3, PCl5, PBr3, PBr5, PI3, SOCl2. Очень эффективным реагентом фторирования является SF4.
а) фторирование SF4:
СН3 – СН2 – ОН + SF4 → 2CН3 – СН2F + SO2 + 2HF
б) действием галогеноводородов:
СН3 –СН2 – ОН + НСl ⇄ СН3 – СН2 – Сl + Н2О
или Хлорэтан
СН3 – СН2 – ОН + КСl + Н2SО4 → СН3 – СН2 – Cl + КНSО4 + Н2О
Хлорэтан
в) действием галогенидов фосфора:
СН3 – СН2 – СН2 – ОН + РСl5 → СН3 – СН2 - СН2 – Сl + НСl + РОСl3
Хлористый пропил
г) действием хлористого тионила:
СН3 – СН2 – СН2 – СН2 – ОН + SОСl2 → СН3 – СН2 – СН2 – СН2 - Сl + SО2 + НСl
При использовании галогенидов фосфора или хлористого тионила, реакция становится необратимой.
Применение хлористого тионила SОСl2 для получения хлоралкилов особенно удобно, так как все побочные продукты этой реакции – растворимые в воде газы, которые легко отделяются от полученного галогеналкила.
Получение галогенпроизводных из альдегидов и кетонов.
Эта реакция осуществляется при действии РCl5, PBr5, SF4 при нагревании:
СН3 – С - Н + РСl5 → СНСl2 + POCl3
уксусный альдегид дихлорэтан
СН3 – С – СН3 + SF4 → CH3 – C – F2 + O = SF2
Ацетон (пропанон, диметилкетон)
2.3.4. Фтористые алкилы получают обменной реакцией из хлористых, бромистых или иодистых алкилов действием фторидов Hg, Ag, Co, Sb и др.:
2С2Н5Вr + НgF2 → 2C2H5F + HgBr2
2.4. Химические свойства.
Галогеналкилы – один из наиболее реакционноспособных классов органических соединений. С их помощью вводят в различные органические соединения алкильные радикалы, то есть они являются алкилирующими реагентами.
1.При каталитическом гидрировании галогеналкилов ( Ni, Pt, Pb) происходит замещение атома галогена водородом:
СН3СН2Cl + Н2 СН3СН3 + НCl
2.Действием раствора солей галогеноводородных кислот в спирте или ацетоне на галогенопроизводные можно заменить один галоген другим. Если заменяют хлор бромом или иодом, то реакцию следует проводить с солями щелочных металлов, так как хлориды хуже растворимы, чем бромиды и иодиды. При замещении галогена с большой атомной массой галогеном с меньшей атомной массой следует применять соли серебра, так как иодид серебра менее растворим, чем бромид и особенно хлорид:
СН3 –СН2 – Сl + NаI → СН3 –СН2 – I + NaCl
СН3 – СН2 – СН2 – I + AgCl → СН3 – СН2 – СН2 – Cl + AgI
3.Большое значение (для получения спиртов из углеводородов) имеет реакция галогеналкилов с водой (ГИДРОЛИЗ). Гидролиз ведут в присутствии едких щелочей или карбонатов щелочных металлов при нагревании, иногда выше температуры кипения воды ( в автоклаве):
СН3 – СН2 – Cl + H2O ⇄ СН3 – СН2 – OH + HCl
СН3 – СН2 – Cl + NaOH → СН3 – СН2 – OH + NaCl
Водный р-р
4.При действии на галогеналкилы алкоголятов образуются простые эфиры:
С2Н5Вr + NаОС2Н5 → С2Н5 – О – С2Н5 + NаВr
Диэтиловый эфир
5.При взаимодействии с аммиаком и аминами галогеналкилы алкилируют их с образованием соответствующих первичных, вторичных и третичных аминов, а также солей аммониевых оснований. Приведем пример реакции образования первичного амина:
СН3I + NH3 → (CH3NH3)+ I- → NH4I + CH3 – NH2
Иодистый метиламмоний метиламин
6.Реакцией галогеналкилов с солями синильной кислоты получают цианистые алкилы (нитрилы) и изонитрилы. Пользуясь этой реакцией, можно перейти от предельных углеводородов к карбоновым кислотам:
СН4 → CH3Cl → CH3CN
Ацетонитрил
СН3 – СN + 2H2O → CH3 – COOH + NH3 (или СН3СООNН4)
7.При нагревании с солями органических кислот галогеналкилы дают сложные эфиры:
С2Н5I + AgO – CO – CH3 → C2H5 – O – CO – CH3 + AgI
Ацетат серебра Уксусноэтиловый эфир
8.При нагревании с нитритом серебра галогеналкилы образуют нитросоединения и эфиры азотистой кислоты:
│ → С2Н5NO2 + AgI
C2H5I + AgNO2 → нитроэтан
│ → С2Н5ОNO + AgI
Этилнитрит
9.При действии на галогеналкилы многих металлов галоген замещается металлом. Это наиболее важный метод синтеза металлоорганических соединений:
С2Н5Вr + 2Li → С2Н5Li + LiBr
Этиллитий
10.При действии спиртового раствора едких щелочей или органических соединений (хинолин, диметиланилин) галогеналкилы отщепляют галогенводород и дают олефины:
СН3 – СН2 – СН2Вr + КОН → СН3 – СН = СН2 + КВr + Н2О
Спиртовой р-р
CH3- CH2 – CH2Cl + KOH → CH3 – CH = CH2 + KCl + H2O
Спиртовой раствор
11. Реакция Вюрца с активным щелочным металлом Na:
2C2H5Cl + 2Na → C2H5 – C2H5 + 2NaCl
2C2H5Br + 2Na → C2H5 – C2H5 + 2NaBr
3.Применение галогенпроизводных предельных углеводородов.
13. Спиртами называют соединения, содержащие одну или несколько гидроксильных групп, непосредственно связанных с углеводородным радикалом.
Классификация спиртов
Спирты классифицируют по различным структурным признакам.
1. По числу гидроксильных групп спирты подразделяются на
o одноатомные (одна группа -ОН)
Например, СH3 – OH метанол, CH3 – CH2 – OH этанол
o многоатомные (две и более групп -ОН).
Современное название многоатомных спиртов - полиолы (диолы, триолы и т.д). Примеры:
двухатомный спирт – этиленгликоль (этандиол)
HO–СH2–CH2–OH
трехатомный спирт – глицерин (пропантриол-1,2,3)
HO–СH2–СН(ОН)–CH2–OH
Двухатомные спирты с двумя ОН-группами при одном и том же атоме углерода R–CH(OH)2 неустойчивы и, отщепляя воду, сразу же превращаются в альдегиды R–CH=O. Спирты R–C(OH)3 не существуют.
2. В зависимости от того, с каким атомом углерода (первичным, вторичным или третичным) связана гидроксигруппа, различают спирты
o первичные R–CH2–OH,
o вторичные R2CH–OH,
o третичные R3C–OH.
Например:
ПЕРВИЧНЫЕ |
ВТОРИЧНЫЕ |
ТРЕТИЧНЫЕ |
R – CH2 – OH |
R – CH – OH │ R |
R │ R – C – OH │ R |
CH3 – OH МЕТАНОЛ
CH3 – CH2 – OH ЭТАНОЛ |
CH3 – CH – OH │ CH3
ПРОПАНОЛ - 2 |
CH3 │ CH3 – C – OH │ C2H5 2- МЕТИЛБУТАНОЛ - 2 |
Типы атомов углерода
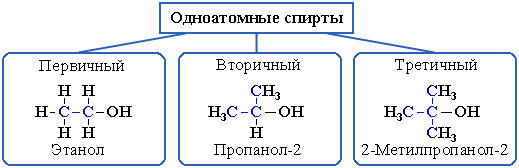
В многоатомных спиртах различают первично-, вторично- и третичноспиртовые группы. Например, молекула трехатомного спирта глицерина содержит две первичноспиртовые (HO–СH2–) и одну вторичноспиртовую (–СН(ОН)–) группы.
3. По строению радикалов, связанных с атомом кислорода, спирты подразделяются на
o предельные (например, СH3 – CH2–OH)
o непредельные (CH2=CH–CH2–OH)
o ароматические (C6H5CH2–OH)
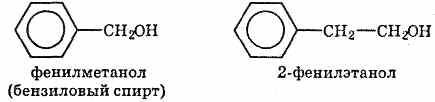
Непредельные спирты с ОН-группой при атоме углерода, соединенном с другим атомом двойной связью, очень неустойчивы и сразу же изомеризуются в альдегиды или кетоны. Например, виниловый спирт CH2=CH–OH превращается в уксусный альдегид CH3–CH=O
Предельные одноатомные спирты
1. Определение
ПРЕДЕЛЬНЫЕ ОДНОАТОМНЫЕ СПИРТЫ – кислородсодержащие органические вещества, производные предельных углеводородов, в которых один атом водорода замещён на функциональную группу (-OH)
Общая формула: CnH2n+1-OH или R-OH или CnH2n+2-O |
2. Гомологический ряд
Химическая формула |
Структурная |
Название Ол (-овый спирт) |
Агрегатное состояние |
CH3OH |
CH3-OH |
Метанол Метиловый спирт |
Жидкость |
C2H5OH |
CH3-CH2-OH |
Этанол |
Жидкость |
|
|
Этиловый спирт |
|
C3H7OH
|
3 2 1 CH3-CH2-CH2-ОН |
Пропанол - 1 |
Жидкость |
|
1 2 3 CH3-CH-CH3 │ OH |
Пропанол - 2 |
Жидкость |
…от С12H25OH |
|
|
Твёрдые вещества, Не растворяются в воде |
Простейшие спирты |
||
Название |
Формула |
Модели |
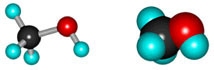
Метиловый спирт (метанол) |
CH3-OH |
|
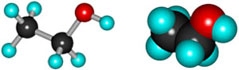
Этиловый спирт (этанол) |
CH3CH2-OH |
|
3. Номенклатура спиртов
Систематические названия даются по названию углеводорода с добавлением суффикса -ол и цифры, указывающей положение гидроксигруппы (если это необходимо). Например:
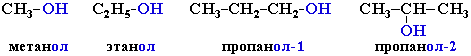
Нумерация ведется от ближайшего к ОН-группе конца цепи.
Цифра, отражающая местоположение ОН-группы, в русском языке обычно ставится после суффикса "ол".

По другому способу (радикально-функциональная номенклатура) названия спиртов производят от названий радикалов с добавлением слова "спирт". В соответствии с этим способом приведенные выше соединения называют: метиловый спирт, этиловый спирт, н-пропиловый спирт СН3-СН2-СН2-ОН, изопропиловый спирт СН3-СН(ОН)-СН3.
4. Изомерия спиртов
Для спиртов характерна структурная изомерия:
изомерия положения ОН-группы (начиная с С3); Например:

углеродного скелета (начиная с С4); Например, формуле C4H9OH соответствует изомеры:
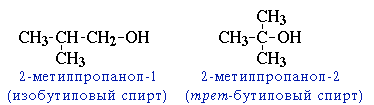
межклассовая изомерия с простыми эфирами Например,
этиловый спирт СН3CH2–OH и диметиловый эфир CH3–O–CH3
Возможна также пространственная изомерия – оптическая.
Например, бутанол-2 СH3CH(OH)СH2CH3, в молекуле которого второй атом углерода (выделен цветом) связан с четырьмя различными заместителями, существует в форме двух оптических изомеров.
5. Строение спиртов
Строение самого простого спирта — метилового (метанола) — можно представить формулами:
H | H—C—OH или CH3—OH | H структурные формулы |
H .. .. H : C : O : H .. .. H электронная формула |
Из электронной формулы видно, что кислород в молекуле спирта имеет две неподеленные электронные пары.
Свойства спиртов и фенолов определяются строением гидроксильной группы, характером ее химических связей, строением углеводородных радикалов и их взаимным влиянием.
Связи О–Н и С–О – полярные ковалентные. Это следует из различий в электроотрицательности кислорода (3,5), водорода (2,1) и углерода (2,4). Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода:
![]()
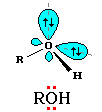
Атому кислорода в спиртах свойственна sp3-гибридизация. В образовании его связей с атомами C и H участвуют две 2sp3-атомные орбитали, валентный угол C–О–H близок к тетраэдрическому (около 108°). Каждая из двух других
2 sp3-орбиталей кислорода занята неподеленной парой электронов.
Подвижность атома водорода в гидроксильной группе спирта несколько меньше, чем в воде. Более "кислым" в ряду одноатомных предельных спиртов будет метиловый (метанол). Он немного "кислее", чем вода. Радикалы в молекуле спирта также играют определенную роль в проявлении кислотных свойств. Обычно углеводородные радикалы понижают кислотное свойства. Но если в них содержатся, электроноакцепторные группы, то кислотность спиртов заметно увеличивается. Например, спирт (СF3)3С—ОН за счет атомов фтора становится настолько кислым, что способен вытеснять угольную кислоту из ее солей.