
- •Теория химического строения органических соединений а.М. Бутлерова
- •3/ Классификация органических соединений
- •4. Механизмы органических реакций
- •Мнемоническое правило
- •6. Гомологические ряды органических соединений
- •7. Предельные углеводороды (алканы). Номенклатура алканов и их производных
- •8. Непредельные углеводороды ряда этилен. Физические свойства
- •Методы получения алкенов
- •Дегидрогалогенирование и дегалогенирование алканов
- •Гидрирование алкинов
- •Химические свойства
- •Окисление
- •Реакции полимеризации
- •Физические свойства некоторых диеновых углеводородов
- •11. Ароматические углеводороды (арены)
- •15. Многоатомные спирты
- •16. Фенолы
- •17/ Альдегиды и их химические свойства
- •18. Одноосновные карбоновые кислоты
- •19. Сложные эфиры
- •20/ Аминокислоты
- •21/ Азотсодержащие гетероциклические соединения. Пиридин
- •22/ Строение полимеров, свойства и синтез полимеров
- •Высокомолекулярные соединения
- •24. Масс-спектрометрия
- •Раздел 2. Электронная уф спектроскопия
- •Раздел 3. Колебательная ик спектроскопия
- •Раздел 4. Спектроскопия ядерного магнитного резонанса
- •25. Амины
21/ Азотсодержащие гетероциклические соединения. Пиридин
Особенности азотсодержащих гетероциклических соединений:
1) среди азотсодержащих соединений особенно много веществ циклического строения;
2) наибольший интерес представляют те из них, где атомы азота входят в состав циклов наряду с углеродными атомами, как атомы кислорода – в циклические молекулы глюкозы, рибозы, дезоксирибозы;
3) соединения, содержащие циклы, в состав которых наряду с атомами углерода входят атомы других элементов, называются гетероциклическими (греч. «гетерос» – другой);
4) возможность существования разнообразных гетероциклов – еще одна из причин неисчерпаемого многообразия органических веществ.
Пиридин как вид азотсодержащего гетероциклического соединения. Его особенности:
1) это шестичленное гетероциклическое соединение с одним гетероатомом азота в цикле:
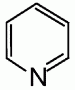
2) это бесцветная жидкость с неприятным запахом, хорошо растворимая в воде;
3) пиридин и его гомологи содержатся в каменноугольной смоле, которая и служит источником их получения;
4) на основании структурной формулы можно высказать двоякое суждение о свойствах пиридина;
5) наличие двойных связей в молекуле указывает на его высокую реакционноспособность, а сходство по строению с бензолом позволяет предположить, что вещество обладает большой химической способностью;
6) пиридин также имеет и много общего с бензолом по строению и свойствам.
В молекуле бензола каждый атом углерода, находясь в состоянии sр2-гибридизации, три электрона затрачивает на образование δ-связей и один электрон – на образование общего для молекулы π-облака (при боковом перекрывании облаков шести р-электронов). В молекуле пиридина одну группу СН заменяет атом азота, и он «поставляет» два электрона на установление δ-связей с двумя соседними углеродными атомами и один электрон – в систему π-облака, при этом, как и в молекуле бензола, образуется устойчивый секстет электронов. У атома азота остается после этого еще пара свободных электронов;
7) пиридин, как и бензол, устойчив по отношению к окислителям: он не обесцвечивает раствор перманганата калия даже при нагревании;
8) пиридин нитруется, реакция идет в более жестких условиях, чем у бензола, образуется нитропиридин.
Гетероциклическое соединение пиридин – это азотистое основание ароматического характера.
Способы применения пиридина: 1) ароматические и основные свойства пиридина используются при синтезе разного рода лекарственных препаратов, красителей, гербицидов; 2) также пиридин используется как растворитель для денатурирования этанола.
22/ Строение полимеров, свойства и синтез полимеров
Низкомолекулярное вещество, из которого синтезируют полимер, называется мономером. Многократно повторяющиеся в макромолекуле группы атомов называются структурными звеньями. Молекула мономера и структурное звено макромолекулы одинаковы по составу, но различны по строению:
1) в данном случае в молекуле пропилена имеется двойная связь между атомами;
2) в структурном звене полипропилена она отсутствует;
3) число n в формуле полимера показывает, сколько молекул мономера соединяется в макромолекулу. Она называется степенью полимеризации.
Макромолекулы полимеров могут иметь различную геометрическую форму:
а) линейную (зигзагообразную), когда структурные звенья соединены в длинные цепи последовательно одно за другим;
б) разветвленную (с ними мы встречались на примере крахмала);
в) пространственную, когда линейные молекулы соединены между собой химическими связями (например, в вулканизированном каучуке – резине).
Геометрическая форма полимеров существенно сказывается на их свойствах.
Свойства полимеров:
1) полимеры могут иметь кристаллическое и аморфное строение;
2) молекулярная масса для полимеров имеет некоторые особенности.
Характерные особенности молекулярной массы.
1. В процессе полимеризации в макромолекулы соединяется различное число молекул мономера в зависимости от того, когда произойдет обрыв растущей полимерной цепи.
2. При этом образуются макромолекулы разной длины и разной массы.
3. Указываемая для такого вещества молекулярная масса – это лишь ее среднее значение, от которого масса отдельных молекул существенно отклоняется в ту или иную сторону.
Например, если молекулярная масса полимера 28 000, то в нем могут быть молекулы с относительной массой 26 000, 28 000, 30 000 и т. д.
Свойства, которые вытекают из особенностей строения полимеров:
1) низкомолекулярные вещества характеризуются определенными температурами плавления, кипения и другими константами;
2) если нагревать какой-нибудь полимер линейной структуры, то будет видно, что он сначала размягчится, а потом, по мере дальнейшего повышения температуры, начнет постепенно плавиться, образуя вязкотекучую жидкость;
3) многие полимеры характеризуются плохой растворимостью;
4) вещества линейной структуры все же могут, хотя и с трудом, растворяться в тех или иных растворителях, образуя весьма вязкие растворы;
5) пространственные полимеры совершенно не растворимы.
Некоторые из них, например резина, могут только набухать в растворителях.
