
- •1.)Тепловое излучение и его характеристики
- •2.)Законы теплового излучения
- •3.)Квантовая гипотеза и формула Планка
- •4.)Энергия и импульс световых квантов. Давление света
- •5.)Внешний, внутренний и вентильный фотоэффект
- •6.)Эффект Комптона и его теория
- •7.)Строение атома водорода в соответствии с теорией Бора
- •8.)Свойства рентгеновского излучения
- •9.)Основные постулаты квантовой механики
- •10.)Волновая функция и уравнение Шредингера
- •11.)Примеры решений уравнения Шредингера
- •12.)Атом водорода в квантовой механике
- •15.)Схема уровней энергии и оптические спектры молекул
- •13.)Квантовые числа в атоме
- •16.)Дифракция электронов и нейтронов. Электронная микроскопия
- •14.)Распределение электронов
- •17.)Спонтанное и вынужденное излучение. Люминесценция
- •19.)Общие сведения о квантовых статиках
- •18.)Лазеры
- •20.) Функции распределения Ферми-Дирака и Бозе – Эйнштейна
- •21.)Статические функции квантового газа
- •22.)Вырожденный электронный газ в металлах
- •23.)Квантовая теория теплоёмкости твёрдых тел
- •24.)Элементы квантовой теории металлов
- •25.)Зонная теория строения твёрдых тел
11.)Примеры решений уравнения Шредингера
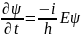

откуда:
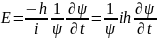

Статистическое толкование волн де Бройля и соотношение неопределенностей Гейзенберга привели к выводу, что уравнением движения в квантовой механике, описывающим движение микрочастиц в различных силовых полях, должно быть уравнение, из которого бы вытекали наблюдаемые на опыте волновые свойства частиц. Основное уравнение должно быть уравнением относительно волновой функции (х, у, z, t), так как именно она, или, точнее, величина ||2, определяет вероятность пребывания частицы в момент времени t в объеме dV, т. е. в области с координатами х и х+dх, у и y+dy, z и z+dz. Так как искомое уравнение должно учитывать волновые свойства частиц, то оно должно быть волновым уравнением, подобно уравнению, описывающему электромагнитные волны. Основное уравнение нерелятивистской квантовой механики сформулировано в 1926 г. Э. Шредингером. Уравнение Шредингера, как и все основные уравнения физики (например, уравнения Ньютона в классической механике и уравнения Максвелла для электромагнитного поля), не выводится, а постулируется. Правильность этого уравнения подтверждается согласием с опытом получаемых с его помощью результатов, что, в свою очередь, придает ему характер закона природы. Уравнение Шредингера имеет вид
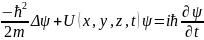 (1)
(1)
где
h=h/(2),
m
—
масса частицы —оператор
Лапласа (=д2/дx2
+д2/дy2+д2/дz2),
i
—
мнимая единица, U(х,
у, z,
t)—
потенциальная функция частицы в силовом
поле, в котором она движется, (х,
у, z,
t)
— искомая
волновая функция частицы. Уравнение
(1) справедливо для любой частицы (со
спином, равным 0; см. ), движущейся с малой
(по сравнению со скоростью света)
скоростью, т. е. со скоростью v<<с.
Оно дополняется условиями, накладываемыми
на волновую функцию: 1) волновая функция
должна быть конечной, однозначной и
непрерывной; 2) производные д/дx,
д/дy,
д/дz,
д/дt
должны быть непрерывны; 3) функция
||2
должна быть интегрируема; это условие
в простейших случаях сводится к условию
нормировки вероятностей. Чтобы прийти
к уравнению Шредингера, рассмотрим
свободно движущуюся частицу, которой,
согласно идее де Бройля, сопоставляется
плоская волна. Для простоты рассмотрим
одномерный случай. Уравнение плоской
волны, распространяющейся вдоль оси х,
имеет
вид (x,t)=Acos(t-kx),
или
в комплексной записи (х,t)=Aеi(t-kx).
Следовательно, плоская волна де Бройля
имеет вид
 (учтено,
что =E/h,
k=p/h).
(учтено,
что =E/h,
k=p/h).
12.)Атом водорода в квантовой механике

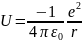

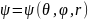
Если
Е<0:

Если Е0, то появляется свободный электрон и полностью ионизированный водород.
15.)Схема уровней энергии и оптические спектры молекул
Виды химической связи в молекуле: ионная (ионы с противоположными зарядами) и атомная (электроны с противоположно направленными спинами)..
Энергия
молекулы:
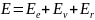
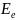 – электронная
энергия;
– электронная
энергия;
 – колебательная
энергия;
– колебательная
энергия;
 – вращательная
энергия;
– вращательная
энергия;
Квантование колебательных и вращательных составляющих энергии молекулы:
Вращательный
спектр состоит из равноотстоящих линий,
расположенных в очень далёкой инфракрасной
области. Колебательный спектр состоит
из линий с частотами:
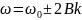
Спектры молекулы состоят из большого числа тесно расположенных линий.
