
- •Предмет теплотехніки. Роль теплотехніки в науково-технічному прогресі. Проблеми економії паливно-енергетичних ресурсів, зниження норм витрати теплоти і палива.
- •Рух і його форми. Енергія та її види. Предмет термодинаміки. Робочі тіла. Поняття про ідеальні та реальні гази. Мета введення поняття про ідеальний газ.
- •Ентальпія. Потенційна енергія тиску. Їх фізичний зміст.
- •Теплота і робота. Їх фізичний зміст та обчислення. Робота розширення та стиснення. Позитивний і негативний напрямок теплоти і роботи. Термодинамічна система та її типи.
- •Перший закон термодинаміки, його зміст, основні формулювання. Принципи еквівалентності енергії. Математичний вираз першого закону термодинаміки в різних формах.
- •Вільна і зв’язана енергія робочого тіла. Поняття про енергію. Енергія Гельмгольца і енергія Гіббса. Їх фізичний зміст і математичні залежності. Енергетична модель робочого тіла.
- •Термодинамічний стан. Параметри стану. Термодинамічний метод. Екстенсивні та інтенсивні параметри стану. Питомі та мольні термодинамічні величини. Рівноважні та нерівноважні стани.
- •Чотири загальні властивості параметрів стану.
- •Термодинамічні потенціали. Чотири потенціали Гіббса. Диференційні рівняння термодинамічних потенціалів.
- •Теплоємність системи (робочого тіла). Питома теплоємність, фізичний зміст, одиниці виміру, залежність між питомими теплоємностями. Залежність теплоємності газу від температури.
- •Середня та дійсна теплоємність. Визначення середньої теплоємності газу при криволінійній та прямолінійній залежності її від температури. Таблиця теплоємностей.
- •Середня уявна молекулярна маса, газова постійна. Густина та питомий об’єм суміші ідеальних газів, парціальний тиск компонентів суміші ідеальних газів, співвідношення для їх знаходження.
- •Властивості реальних газів. Рівняння Ван-Дер-Ваальса для 1 кг газу. Внутрішній молекулярний тиск газу. Зміст константи в рівнянні Ван-Дер-Ваальса.
- •Термодинамічний процес. Рівноважний та нерівноважний процес. Графічний метод дослідження процесу. Прямий і зворотній процеси.
- •Оборотний та необоротний процеси. Умови проходження оборотних процесів. Облік незворотності в дійсних процесах.
- •Визначення значень зміни внутрішньої енергії, ентальпії та ентропії робочого тіла при зміні його стану.
- •Графічний метод вивчення термодинамічних процесів. Pv та ts –діаграми та їх властивості.
- •Ентропія робочого тіла. Фізичний зміст. Розмірність. Математичний вираз.
- •Характеристики термодинамічного процесу. Теплота і робота. Властивості їх диференціалів. Графічне зображення для розімкнутих та кругових процесів.
- •Характеристики термодинамічного процесу. Коефіцієнт перетворення енергії в процесаі (кпе). Коефіцієнт використання термодинамічного потенціалу в процесі (квп).
- •Ізохорний процес в ідеальних газах. Рівняння процесу в pv та ts координатах. Зображення процесу на pv та ts –діаграмах.
- •Політропний процес в ідеальних газах. Залежність для зміни параметрів стану робочого тіла.
- •Обчислення роботи. Значення політропи для основних термодинамічних процесів. Визначення показника ступеня політропи.
- •Другий закон термодинаміки, його зміст та основні формулювання. Умови перетворення теплоти в роботу в безперервно діючому тепловому двигуні.
- •Кругові процеси чи цикли. Цикли прямі та зворотні, оборотні та необоротні. Термічний ккд циклу.
- •Прямий оборотний цикл Карно. Зображення циклу на pv та ts –діаграмах: вивести вираз для термічного ккд циклу. Аналіз циклу на основі виразу термічного ккд.
- •З воротний оборотний цикл Карно. Холодильний коефіцієнт.
- •Теорема Карно.
- •Узагальнений (регенеративний цикл) Карно та його ккд. Необоротний цикл Карно та його ккд.
- •Властивості оборотного циклу. Перший та другий інтеграл Клаузіуса.
- •Зміна ентропії ізольованої кінцевої системи при оборотних на необоротних процесах. Математичний вираз другого закону термодинаміки. Принцип зростання ентропії.
- •Ексергія теплоти та фізичний зміст ентропії. Рівняння Гюі-Стодоли. Визначення зміни ексергії в основних термодинамічних процесах. Ексергетичний ккд.
- •Ентропія води, вологої та сухої, насиченої та перегрітої пари. Їх знаходження.
- •Знаходження питомого об’єму та густини вологої насиченої пари. Знаходження ентальпії та внутрішньої енергії вологої насиченої перегрітої пари.
- •Hs діаграма водяної пари, її побудова та застосування. Визначення параметрів стану вологої насиченої, сухої насиченої та перегрітої пари на hs діаграмі.
- •Ізобарний процес зміни стану водяної пари. Зображення процесу на pv, hs та ts діаграмах. Визначення роботи зміни внутрішньої енергії та параметрів стану пари.
- •Адіабатний процес зміни стану водяної пари. Зображення процесу на pv, hs та ts діаграмах. Визначення роботи зміни об’єму та параметрів стану.
- •Рівняння першого закону термодинаміки для потоку, фізичний зміст кожного члена рівняння, різні форми рівняння.
- •Швидкість витоку ідеального газу при адіабатному процесі. Рівняння для його визначення та аналізу. Швидкість витоку водяної пари та її визначення.
- •Секундна витрата ідеального газу при витоку. Рівняння для визначення та його аналіз. Гіпотеза Сен-Венана. Критичне відношення тисків при витоку ідеальних газів, рівняння для його визначення.
- •Вибір профілю сопла в залежності від критичного відношення тисків. Виток газу через комбіноване сопло. Розрахунок комбінованого сопла.
- •Витоки водяної пари та його особливості. Визначення швидкості водяної пари при різних умовах. Виток газів та пари при наявності тертя.
- •Дроселювання реальних газів. Ефект Джоуля-Томпсона. При яких умовах ефект дроселювання додатній, від’ємний чи рівний нулю. Інверсія, точка інверсії, температура інверсії.
- •Дослідження дроселювання водяної пари різних станів по hs діаграмі.
- •Причини виникнення двз зі змішаним згоранням палива. Теоретичний цикл цих двигунів. Зображення циклу в pv та ts –діаграмах, характеристики циклу, термічний ккд циклу, аналіз ккд циклу.
- •Принципова схема паросилової установки, що працює по циклу Ренкіна. Зображення циклу в pv та ts –діаграмах.
- •Вплив початкових та кінцевих параметрів пари на ккд циклу паросилової установки. Дати аналіз з використанням hs –діаграми. Відносний внутрішній ккд циклу.
- •Принципова схема паросилової установки, що працює по теплофікаційному циклу. Зображення циклу в pv та ts –діаграмах. Коефіцієнт використання теплоти циклі, порівняння з конденсаційним циклом.
- •Цикл газотурбінної установки(гту). Переваги гту перед двз. Термічний ккд гту.
- •Вологе повітря. Визначення. Абсолютна та відносна вологість, вологоємність. Точка роси. Hd –діаграма вологого повітря. Основні процеси вологого повітря в hd –діаграмі.
- •Відмінність паротурбінної установки від двз. Цикл Карно для насиченої пари.
- •Цикл паротурбінної установки з проміжним перегрівом пари. Економічність проміжного перегріву пари. Термічний ккд циклу, факти, які впливають на його величину.
- •Регенеративний цикл паросилової установки. Ціль використання. Ефективність застосування циклу. Питома витрата пари для регенеративного циклу.
- •Цикл теплового насосу. Доцільність використання теплового насосу. Опалювальний коефіцієнт. Його визначення. Переваги використання теплового насосу.
- •Цикл теплового насосу. Призначення та область застосування теплових насосів. Опалювальний коефіцієнт та його визначення
Предмет теплотехніки. Роль теплотехніки в науково-технічному прогресі. Проблеми економії паливно-енергетичних ресурсів, зниження норм витрати теплоти і палива.
Предмет технічної термодинаміки – виявлення законів взаємного перетворення енергії хаотичного і направленого руху, а також властивостей робочих тіл. Газоподібні тіла розглядаються реальні та ідеальні.
В природі енергія в своїй більшості знаходиться в одних видах (переважно, в хімічному), а використовує людство її в інших видах (теплову та електричну). Перехід одного виду енергії в інший проходить через наявність фізичних тіл, які є носіями енергії і приймають участь у перетворенні одного виду енергії в інший. Такі фізичні тіла називаються робочими тілами.
Рух і його форми. Енергія та її види. Предмет термодинаміки. Робочі тіла. Поняття про ідеальні та реальні гази. Мета введення поняття про ідеальний газ.
Технічна термодинаміка розглядає хаотичний і направлений рухи.
Хаотичним називається рух, під час якого молекули газу рухаються в різних напрямках, і ні один із них не є переважним.
Завдяки хаотичному рухові газ має такі дві властивості:
1. Він діє на всі стінки посудини, в якій він знаходиться, з однаковою силою.
2. Газ рівномірно заповнює весь об'єм, в якому він знаходиться.
Направлений рух – це рух, в якому макрочастини газу рухаються в певному напрямку.
К ожній
науці, які вивчає технічна тер-модинаміка,
відповідає свій вид руху та, відповідно,
енергії:
ожній
науці, які вивчає технічна тер-модинаміка,
відповідає свій вид руху та, відповідно,
енергії:
електротехніка - напрямлений рух електронів;
механіка - механічна форма ру-ху, механічна енергія;
квантова механіка - рух малих частинок речовини;
хімічна термодинаміка – хімічна енергія.
Предмет технічної термодинаміки – виявлення законів взаємного перетворення енергії хаотичного і направленого руху, а також властивостей робочих тіл. Газоподібні тіла розглядаються реальні та ідеальні.
Перехід одного виду енергії в інший проходить через наявність фізичних тіл, які є носіями енергії і приймають участь у перетворенні одного виду енергії в інший. Такі фізичні тіла називаються робочими тілами.
Реальний газ – газ, у якого існують си-ли щеплення між молекулами, а самі моле-кули є тіла, що не мають об’єму. Вивчаючи властивості реальних газів, отримують складні математичні залежності, які неп-ридатні для інженерних розрахунків, тому введене поняття ідеального газу, тобто газу, в якому відсутні сили щеплення між моле-кулами, а молекули не мають об’єму.
Ентальпія. Потенційна енергія тиску. Їх фізичний зміст.
Розглянемо рівняння стану для 1 кг га-зу.
 ;
;
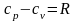 ;
;
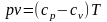 ;
;
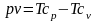 ;
;
 ;
;
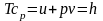 ;
;
 – повна енергія робочого тіла, або
ентальпія.
– повна енергія робочого тіла, або
ентальпія.
Це рівняння для m кг:
H=U+pV
Також, як і внутрішня енергія, ентальпія є функція тільки від температури.

Широко зас-тосовують об’єднаний закон Бойля-Маріотта і Гей-Люссака.

 – абсолютний тиск,
– абсолютний тиск,
 – питомий об’єм,
– питомий об’єм,
 –
–
 – це є енергія 1 кг газу і
називається вона потенціальна
енергія тиску.
– це є енергія 1 кг газу і
називається вона потенціальна
енергія тиску.
З акон
Бойля-Маріотта
акон
Бойля-Маріотта
під
час

 .
.
Теплота і робота. Їх фізичний зміст та обчислення. Робота розширення та стиснення. Позитивний і негативний напрямок теплоти і роботи. Термодинамічна система та її типи.
Якщо два тіла, які мають різні температури, знаходяться у контакті і обмінюються енергією, яка передається більш нагрітим тілом менш нагрітому у формі енергії хаотичного руху молекул, то це називається теплотою. Теплота це не самостійний вид енергії. Це енергія хаотичного руху молекул. В робочому тілі теплота не знаходиться. Теплота це форма енергообміну системи. Щоб відрізнити енергію хаотичного руху молекул, яка знаходиться всередині системи, від такої ж енергії, яка передається і знаходиться за межами системи, від такої ж енергії, яка передається і знаходиться за межами системи, введено поняття теплоти. Теплота, перетинаючи границю системи, поглинається цією системою і стає її внутрішньою енергією. Таким чином – теплота це потік енергії хаотичного руху молекул.
Теплота Q – m кг, Дж, кДж
q
– 1 кг,
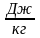 ,
,
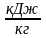 .
.
Визначається теплота так:


У робочому тілі теплоти немає. У ньому є лише внутрішня енергія. Теплота не є окремий вид енергії.
Якщо два тіла знаходяться у контакті, і одне з них розширюється, збільшує свій об’єм і зміщує друге тіло, то така форма переносу енергії від одного тіла до іншого називається роботою. У цьому випадку робоче тіло здійснює роботу відносно до зовнішнього тіла, тобто проти зовнішніх сил і її називають зовнішньою роботою (роботою розширення). Роботу, яку здійснюють зовнішні сили відносно до робочого тіла із зменшенням його об’єму називають роботою стиснення.
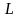 – m
кг, Дж, кДж;
– m
кг, Дж, кДж;
 – 1 кг,
,
;
– 1 кг,
,
;
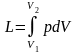 ;
;
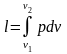 .
.
Робота і теплота є величини алгебраїчні. При розрахунку енергетичного балансу робочого тіла треба брати до уваги напрямок переміщення енергії відносно до робочого тіла. Якщо теплота підводиться до робочого тіла, то вона позначається зі знаком плюс, якщо відводиться, то із знаком мінус. Якщо робоче тіло розширюється, то dV при цьому додатнє і робота позначається зі знаком плюс. Якщо робоче тіло стискується, то «-». Енергія завжди додатня. Алгебраїчний знак перед символом вказує на напрямок її переміщення.
Сукупність фізичних тіл, які приймають участь у перетворенні енергії, можуть вступати в енергетичну взаємодію між собою, а також обмінюватися речовиною, називаються термодинамічною системою.
Термодинамічні системи бувають:
Ізольовані – системи, які не обмінюються з навколишнім середовищем ні енергією, ні масою;
Енергетично ізольована – обмінюється тільки масою;
Закритою – не обмінюється речовиною;
Відкритою – обмінюється і речовиною, і енергією;
Адіабатною – обмінюється речовиною та роботою, але не теплотою.
