
- •1. Что изучает физическая химия, ее связь с другими науками, применение в дорожном строительстве.
- •2. Строение вещества. Объяснить суть притяжения молекул друг к другу.
- •3. Положения о химической связи.
- •4. Объяснить суть притяжения молекул друг к другу. Силы Ван-дер-Ваальса.
- •5. Агрегатные состояния вещества.
- •6. Газообразное состояние вещества.
- •7. Твердые тела. Типы кристаллов.
- •8. Жидкое состояние вещества.
- •9. Определение плотности растворов.
- •10. Зависимость плотности от концентрации раствора.
- •11. Поверхностные явления.
- •12. Чем отличаются состояния вещества на границе раздела фаз.
- •13. Что такое поверхностное натяжение.
- •14. Причины возникновения поверхностного натяжения.
- •15. В чем измеряется поверхностное натяжение. Методы определения.
- •16. Физический смысл единицы измерения поверхностного натяжения.
- •17. За счет чего понижается поверхностное натяжение.
- •18. Зависимость поверхностного натяжения от концентрации.
- •19. Определение поверхностного натяжения методом сталагмометра.
- •20. Адсорбция. Чем она сопровождается.
- •21. Уравнение, связывающее адсорбцию с изменением поверхностного натяжения.
- •22. Поверхностно-активные вещества.
- •25. Распределение молекул пав на поверхности раздела фаз.
- •27. Смачивание твердого тела жидкостью.
- •28. Объяснить в каких случаях жидкость смачивает твердое тело.
- •29. Какой показатель характеризует вязкость. Метод определения вязкости.
- •30. От чего зависит вязкость.
- •31. Понятие о коллоидных системах.
- •32. Набухание полимера. Сущность процесса.
- •33. Что называется эмульсиями. Типы эмульсий.
- •34. Эмульсия, состав и свойства.
- •35. Свойства эмульсий, разбавленных и концентрированных и их характеристика.
- •36. Эмульгаторы для разбавленных эмульсий.
- •37. Эмульгаторы для концентрированных эмульсий.
- •38. Процесс разложения эмульсии (чем вызван).
- •39. Однокомпонентная система (показать диаграмму состояния системы фазовых равновесий).
- •40. Двух и трехкомпонентные системы (Диаграмма кремнезема. Графическая зависимость от температуры).
- •41. Применение известково-зольного вяжущего в дорожном строительстве
- •42. Определение химической активности золы. Применение золы в дорожном строительстве.
- •43. Влияние Физико-Химических процессов на сцепление органического вяжущего с минеральным наполнителем.
- •44. В каком виде и для чего вводятся добавки в бетонную смесь.
- •45. Влияние природы реагирующих веществ на скорость химической реакции на примере неорганических вяжущих.
- •47. Поверхностные явления. Их применение в дорожном строительстве.
- •49. Влияние каучуковых добавок на физико-химические свойства асфальтобетона.
- •50. Суспензии в строительстве.
6. Газообразное состояние вещества.
Газы - (французское gaz; название предложено голланским учёным Я. Б. Гельмонтом), агрегатное состояние вещества, в котором его частицы не связаны или весьма слабо связаны силами взаимодействия и движутся свободно, заполняя весь предоставленный им объём.
Любое вещество можно перевести в газообразное состояние надлежащим подбором давления и температуры. Поэтому возможную область существования газообразного состояния графически удобно изобразить в переменных: давление р - температура Т.
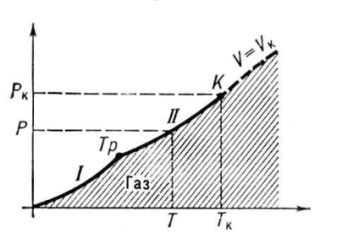
Диаграмма состояния вещества
Для идеального газа нетрудно установить связь между давлением, объемом и средней квадратичной скоростью движения молекул. (pv)τ - const – закон Бойля: объем данной массы газа при постоянной температуре обратно пропорционален давлению. Если давление постоянно то объем будет прямо пропорционален абсолютной температуре - это закон Гей-Люсака для термического расширения газа.
7. Твердые тела. Типы кристаллов.
В твердом веществе расстояния между частицами (молекулами, атомами, ионами) малы, и силы их взаимодействия велики. Твердое тело имеет определенный объем и форму, его частицы не перемещаются свободно, а расположены определенным образом в пространстве по отношению друг к другу. Частицы твердого вещества колеблются около равновесных положений. Различают две формы твердого вещества - кристаллическую и аморфную. В кристаллическом веществе частицы располагаются в пространстве в определенном порядке и образуют кристаллическую решетку. В аморфном веществе они располагаются беспорядочно. Одно и то же вещество можно получить как в кристаллической, так в аморфной форме.
Классификация кристаллических форм основана на симметрии кристаллов. Здесь укажем только, что все разнообразие кристаллических форм может быть сведено к семи группам, или кристаллическим системам, которые, в свою очередь, подразделяются на классы. В зависимости от природы частиц, находящихся в узлах кристаллической решетки, и оттого, какие силы взаимодействия между ними преобладают в данном кристалле, различают молекулярные, атомные, ионные и металлические решетки. В узлах молекулярных решеток находятся молекулы. Они связаны друз с другом межмолекулярными силами. В узлах атомных решеток находятся атомы; они связаны друг с другом ковалентной связью. В узлах ионных решеток располагаются, чередуясь, положительно и отрицательно заряженные ионы. Они связаны друг с другом силами электростатического притяжения. Наконец в узлах металлических решеток находятся атомы металла, между которыми свободно движутся общие для этих атомов электроны. Молекулярные и атомные решетки присущи веществам с ковалентной связью, ионные - ионным соединениям, металлические – металлам и их сплавам. Веществ, обладающих атомными (алмаз, кремний и некоторые неорганические соединения) молекулярной (неметаллы) решетками ионной связью (солен и небольшое число оксидов) сравнительно мало.
8. Жидкое состояние вещества.
В жидкостях расстояния между молекулами гораздо меньше, чем в газах. И поэтому силы взаимодействия проявляются отчетливо. Внутреннее давление в жидких системах измеряется десятками тысяч атмосфер, поэтому и характер движения молекул в жидкостях имеет своеобразные черты Установлено, что в жидкостях существует «ближний порядок» Это значит, что в среднем вокруг каждой молекулы ее соседи расположены менее упорядочено. Предполагалось, что в жидкостях постоянно возникают и распадаются группы правильно ориентированных частиц. Молекулы жидкости относительно долгое время проводят, внутри такой группы, и лишь изредка совершается скачок на расстояние. Опыт и расчеты показывают, что среднее расстояние между ближайшими частицами в жидкости почти не отличается от расстояний в кристалле. Плавление и нагревание сопровождаются расширением, которое обусловлено не увеличением расстояния между частицами, а уменьшением числа ближайших соседей у молекул жидкости. Это число при температурах, не слишком далеких от точки плавления, у простых жидкостей немного меньше координационного числа, характерного для кристаллической структуры. Координационное число в различных жидкостях колеблется приблизительно на 40%.
