
- •61)Буферные системы
- •62)Классификация буферных систем.
- •63)Механизм действия ацетатного буфера.
- •71)79)Механизм действия фосфатного буфера.Уравнение Гендерсона-Гассельбаха.
- •70)71)75)Гидрокарбонатный и аммифчный буфер.Уравнение Гендерсона-Гассельбаха.
- •80)Механизм действия белкового буфера.
- •72)73)74)PH крови и буф системы.
- •64)65)Уравнению Гендерсона-Гассельбаха для расчет рН буферных систем.
- •66)Буферная емкость.67)Формулы для её расчета по к-ти и щёлочи.
- •68)Факторы, влияющие на буферную емкость.Максимум буферной ёмкости.
- •84)Буф системы плазмы крови.
- •81)Алкалоз и ацидоз.82)Метаболический и Респираторный ацидоз-алкалоз.
70)71)75)Гидрокарбонатный и аммифчный буфер.Уравнение Гендерсона-Гассельбаха.
механизм действия гидрокарбонатного буфера
бикарбонатный буфер состоит из угольной кислоты Н2СО3 и гидрокарбоната натрия NaНСО3
- угольная кислота – слабый электролит
Н2СО3 НСО3- + Н+ НСО3- СО32- + Н+(эта стадия практически, не идет)
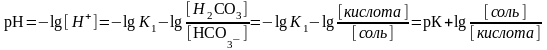
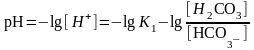
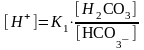
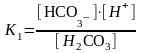
где К1=3,310-7 - коэффициент диссоциации угольной кислоты
- гидрокарбонат натрия – сильный электролит
NaНСО3 НСО3- + Na+ НСО3- СО32- + Н+(эта стадия практически, не идет)
гидрокарбонат натрия увеличивает концентрацию аниона НСО3-
равновесие реакции Н2СО3 НСО3- + Н+ смещается влево
диссоциация угольной кислоты тормозится
практически, анион НСО3- образуется только путем диссоциации гидрокарбоната натрия NaНСО3
молярная концентрация аниона НСО3- равна молярной концентрации соли [НСО3-]=[NaНСО3]
- рН гидрокарбонатного буфера определяет К1=3,310-7 и соотношение концентрации угольной кислоты и NaНСО3
уравнение Гендерсона-Гассельбаха для расчета рН буферных систем кислотного типа
где рК – показатель кислотности угольной кислоты
- при разбавлении гидрокарбонатного буфера соотношение концентрации кислоты и соли не меняется,
поэтому при разбавлении рН гидрокарбонатного буфера сохранится
- при добавлении кислоты идет реакция кислоты и гидрокарбоната натрия
НСО3- + Na+ + H+ + Cl- Н2СО3 + Na+ + Cl-
катионы водорода H+ связываются анионами угольной кислоты НСО3- + H+ Н2СО3
рН гидрокарбонатного буфера изменится за счет увеличения концентрации угольной кислоты и уменьшения соли
механизм изменения рН:
*хотя образуется избыток угольной кислоты Н2СО3 и
равновесие реакции Н2СО3 НСО3- + Н+ смещается вправо,
но по закону Освальда повышение концентрации Н2СО3 снижает степень ее диссоциации,
и концентрация катионов водорода H+ увеличивается незначительно,
поэтому при добавлении кислоты рН гидрокарбонатного буфера, практически, не изменится
- при добавлении основания идет реакция основания и угольной кислоты
Н2СО3 + Na+ + ОН- НСО3- + Na+ + Н2О
гидроксид-ионы ОH- связываются катионами водорода угольной кислоты ОН- + H+ Н2О
рН гидрокарбонатного буфера изменится за счет увеличения концентрации соли и уменьшения концентрации к-ты
механизм изменения рН:
*хотя образуется избыток аниона угольной кислоты НСО3- и
равновесие реакции Н2СО3 НСО3- + Н+ смещается влево,
но по закону Освальда снижение концентрации Н2СО3 повышает степень ее диссоциации,
и концентрация катионов водорода H+ уменьшается незначительно,
*хотя угольная кислота расходуется,
но диссоциируют на катионы водорода H+ только часть молекул кислоты,
которая восполняется за счет недиссоциирующих молекул, и диссоциация не прекращается,
поэтому при добавлении основания рН гидрокарбонатного буфера, практически, не изменится
- при добавлении небольших количеств кислот-щелочей изменение рН гидрокарбонатного буфера невелико
при добавлении больших количеств кислот-щелочей изменение рН гидрокарбонатного буфера значительно
механизм действия аммиачного буфера
аммиачный буфер состоит из гидроксида аммония Н2СО3 и хлорида аммония NH4Cl
- гидроксид аммония – слабый электролит
NH4OH ОH- + NH4+
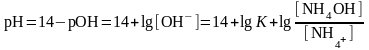
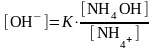
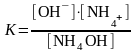
где К=1,8710-5 - коэффициент диссоциации гидроксида аммония
- хлорид аммония – сильный электролит
NH4Cl Сl- + NH4+
хлорид аммония увеличивает концентрацию аниона Сl-
равновесие реакции NH4OH ОH- + NH4+ смещается влево
диссоциация гидроксида аммония тормозится
практически, катион NH4+ образуется только путем диссоциации хлорида аммония NH4Cl
молярная концентрация катион NH4+ равна молярной концентрации соли [NH4+]=[NH4Cl]
-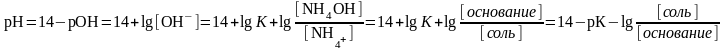 рН аммиачного буфера определяет
К=1,8710-5
и соотношение концентрации гидроксида
аммония и NH4Cl
рН аммиачного буфера определяет
К=1,8710-5
и соотношение концентрации гидроксида
аммония и NH4Cl

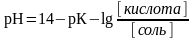
уравнение Гендерсона-Гассельбаха для расчета рН буферных систем основного типа
где рК – показатель основного гидроксида аммония
- при разбавлении аммиачного буфера соотношение концентрации основания и соли не меняется,
поэтому при разбавлении рН аммиачного буфера сохранится
- при добавлении кислоты идет реакция кислоты и гидроксида аммония
NH4OH + H+ + Cl- NH4+ + Cl- + Н2О
катионы водорода H+ связываются гидроксид-ионами гидроксида аммония ОН- + H+ Н2О
рН аммиачного буфера изменится за счет уменьшения концентрации основания и увеличения соли
механизм изменения рН:
*хотя образуется избыток катионов NH4+ и
равновесие реакции NH4OH ОH- + NH4+ смещается влево,
но по закону Освальда снижение концентрации NH4OH повышает степень его диссоциации,
и концентрация гидроксид-ионов ОН- уменьшается незначительно,
*хотя гидроксид аммония расходуется,
но диссоциируют на гидроксид-ионы ОН- только часть молекул основания,
которая восполняется за счет недиссоциирующих молекул, и диссоциация не прекращается,
поэтому при добавлении кислоты рН аммонийного буфера, практически, не изменится
- при добавлении основания идет реакция основания и хлорида аммония
NH4+ + Cl- + Na+ + ОН- NH4OH + Na+ + Cl-
гидроксид-ионы ОH- связываются катионами NH4+ соли ОН- + NH4+ NH4OH
рН аммиачного буфера изменится за счет увеличения концентрации гидроксида аммония и уменьшения соли
механизм изменения рН:
*хотя образуется избыток гидроксида аммония NH4OH и
равновесие реакции NH4OH ОH- + NH4+ смещается вправо,
но по закону Освальда повышение концентрации NH4OH снижает степень ее диссоциации,
и концентрация гидроксид-ионы ОН- увеличивается незначительно,
поэтому при добавлении основания рН аммиачного буфера, практически, не изменится
- при добавлении небольших количеств кислот-щелочей изменение рН аммиачного буфера невелико
при добавлении больших количеств кислот-щелочей изменение рН аммиачного буфера значительно
