
- •.Рух і його форми. Енергія та її види. Предмет термодинаміки. Робочі тіла. Поняття про ідеальні та реальні гази. Мета введення поняття про ідеальний газ
- •Ентальпія. Потенційна енергія тиску. Їх фізичний зміст.
- •Теплота і робота. Їх фізичний зміст та обчислення. Робота розширення та стиснення. Позитивний і негативний напрямок теплоти і роботи. Термодинамічна система та її типи.
- •Перший закон термодинаміки, його зміст, основні формулювання. Принципи еквівалентності енергії. Математичний вираз першого закону термодинаміки в різних формах
- •Вільна і зв’язана енергія робочого тіла. Поняття про енергію. Енергія Гельмгольца і енергія Гіббса. Їх фізичний зміст і математичні залежності. Енергетична модель робочого тіла.
- •Термодинамічний стан. Параметри стану. Термодинамічний метод. Екстенсивні та інтенсивні параметри стану. Питомі та мольні термодинамічні величини. Рівноважні та нерівноважні стани.
- •Чотири загальні властивості параметрів стану.
- •Термодинамічні потенціали. Чотири потенціали Гіббса. Диференційні рівняння термодинамічних потенціалів.
- •Теплоємність системи (робочого тіла). Питома теплоємність, фізичний зміст, одиниці виміру, залежність між питомими теплоємностями. Залежність теплоємності газу від температури.
- •Середня та дійсна теплоємність. Визначення середньої теплоємності газу при криволінійній та прямолінійній залежності її від температури
- •Середня уявна молекулярна маса, газова постійна. Густина та питомий об’єм суміші ідеальних газів, парціальних тиск компонентів сумішей ідеальних газів, співвідношення для їх знаходження.
- •Властивості реальних газів. Рівняння Ван Дер Ваальса для 1 кг газу. Внутрішній молекулярний тиск газу. Зміст константи в рівнянні Ван Дер Ваальса.
- •Термодинамічний процес. Рівноважний та нерівноважний процес. Графічний метод дослідження процесу. Прямий і зворотній процеси.
- •Оборотний та необоротний процеси. Умови проходження оборотних процесів. Облік незворотності в дійсних процесах.
- •Визначення значень зміни внутрішньої енергії, ентальпії та ентропії робочого тіла при зміні його стану.
- •Графічний метод вивчення термодинамічних процесів. Pv та ts –діаграми та їх властивості.
- •Ентропія робочого тіла. Фізичний зміст. Розмірність. Математичний вираз.
- •Характеристики термодинамічного процесу. Теплота і робота. Властивості їх диференціалів. Графічне зображення для розімкнутих та кругових процесів.
- •Характеристики термодинамічного процесу. Коефіцієнт перетворення енергії в процесаі (кпе). Коефіцієнт використання термодинамічного потенціалу в процесі (квп).
- •Ізохорний процес в ідеальних газах
- •Ізобарний процес в ідеальних газах
- •Політропний процес в ідеальних газах. Залежність для зміни параметрів стану робочого тіла
- •Обчислення роботи. Значення політропи для основних термодинамічних процесів. Визначення показника ступеня політропи.
- •Другий закон термодинаміки, його зміст та основні формулювання. Умови перетворення теплоти в роботу в безперервно діючому тепловому двигуні.
- •Кругові процеси чи цикли. Цикли прямі та зворотні, оборотні та необоротні. Термічний ккд циклу.
- •Прямий оборотний цикл Карно. Зображення циклу на pv та ts –діаграмах: вивести вираз для термічного ккд циклу. Аналіз циклу на основі виразу термічного ккд.
- •Зворотний оборотний цикл Карно. Холодильний коефіцієнт.
- •Теорема Карно.
- •Узагальнений (регенеративний цикл) Карно та його ккд. Необоротний цикл Карно та його ккд.
- •Властивості оборотного циклу. Перший та другий інтеграл Клаузіуса.
- •Зміна ентропії ізольованої кінцевої системи при оборотних на необоротних процесах. Математичний вираз другого закону термодинаміки. Принцип зростання ентропії.
- •Ексергія теплоти та фізичний зміст ентропії. Рівняння Гюі-Стодоли. Визначення зміни ексергії в основних термодинамічних процесах. Ексергетичний ккд.
- •Водяна пара як реальний газ.
- •Ентропія води, вологої та сухої, насиченої та перегрітої пари. Їх знаходження.
- •Знаходження питомого об’єму та густини вологої насиченої пари. Знаходження ентальпії та внутрішньої енергії вологої насиченої перегрітої пари.
- •Hs діаграма водяної пари, її побудова та застосування. Визначення параметрів стану вологої насиченої, сухої насиченої та перегрітої пари на hs діаграмі.
- •Ізобарний процес зміни стану водяної пари. Зображення процесу на pv, hs та ts діаграмах. Визначення роботи зміни внутрішньої енергії та параметрів стану пари.
- •Адіабатний процес зміни стану водяної пари. Зображення процесу на pv, hs та ts діаграмах. Визначення роботи зміни об’єму та параметрів стану.
- •Рівняння першого закону термодинаміки для потоку, фізичний зміст кожного члена рівняння, різні форми рівняння.
- •Швидкість витоку ідеального газу при адіабатному процесі. Рівняння для його визначення та аналізу. Швидкість витоку водяної пари та її визначення.
- •Секундна витрата ідеального газу при витоку. Рівняння для визначення та його аналіз. Гіпотеза Сен-Венана. Критичне відношення тисків при витоку ідеальних газів, рівняння для його визначення.
- •Вибір профілю сопла в залежності від критичного відношення тисків. Виток газу через комбіноване сопло. Розрахунок комбінованого сопла.
- •Витоки водяної пари та його особливості. Визначення швидкості водяної пари при різних умовах. Виток газів та пари при наявності тертя.
- •Дослідження дроселювання водяної пари різних станів по hs діаграмі.
- •Термодинамічні основи роботи поршневого компресора. Зображення роботи одноступінчатого компресора на pv діаграмі при ізотермічному, адіабатному та політропному стиску газу.
- •Робочий процес багатоступінчастого поршневого компресора. Зображення теоретичного робочого процесу триступінчастого компресора на pv та ts –діаграмах.
- •Що призвело до появи двигунів внутрішнього згорання(двз). На які групи діляться поршневі двз та яке паливо в них використовується? Індикаторна діаграма двз. Термодинамічний метод вивчення двз.
- •Причини виникнення двз зі змішаним згоранням палива. Теоретичний цикл цих двигунів. Зображення циклу в pv та ts –діаграмах, характеристики циклу, термічний ккд циклу, аналіз ккд циклу.
- •Принципова схема паросилової установки, що працює по циклу Ренкіна. Зображення циклу в pv та ts –діаграмах.
- •Вплив початкових та кінцевих параметрів пари на ккд циклу паросилової установки. Дати аналіз з використанням hs –діаграми. Відносний внутрішній ккд циклу.
- •Принципова схема паросилової установки, що працює по теплофікаційному циклу. Зображення циклу в pv та ts –діаграмах. Коефіцієнт використання теплоти циклі, порівняння з конденсаційним циклом.
- •Цикл газотурбінної установки(гту). Переваги гту перед двз. Термічний ккд гту.
- •Вологе повітря. Визначення. Абсолютна та відносна вологість, вологоємність. Точка роси. Hd –діаграма вологого повітря. Основні процеси вологого повітря в hd –діаграмі.
- •Відмінність паротурбінної установки від двз. Цикл Карно для насиченої пари.
- •Цикл паротурбінної установки з проміжним перегрівом пари. Економічність проміжного перегріву пари. Термічний ккд циклу, факти, які впливають на його величину.
- •Регенеративний цикл паросилової установки. Ціль використання. Ефективність застосування циклу. Питома витрата пари для регенеративного циклу.
- •Цикл теплового насосу. Доцільність використання теплового насосу. Опалювальний коефіцієнт. Його визначення. Переваги використання теплового насосу.
- •Цикл теплового насосу. Призначення та область застосування теплових насосів. Опалювальний коефіцієнт та його визначення
Оборотний та необоротний процеси. Умови проходження оборотних процесів. Облік незворотності в дійсних процесах.
Н ехай
кулька рухається по впуклій поверхні.
Якщо нема тертя, то вона підніметься на
ту ж висоту, з якої почала свій рух. Якщо
є тертя, то частина енергії кулька
втратить на те, щоб подолати сили тертя.
Поступово її рух затихне. Оборотним
називається
процес,
в якому робоче тіло проходить в прямому
і зворотному напрямках через одні і ті
ж самі проміжні стани, і після цього
повертається в початковий стан без
витрати на то енергії ззовні. Необоротним
називають
процес,
в якому робоче тіло після завершення
зворотного процесу не може повернутись
в початковий стан без витрати енергії
ззовні. Для протікання оборотного
процесу необхідно виконати такі умови:
ехай
кулька рухається по впуклій поверхні.
Якщо нема тертя, то вона підніметься на
ту ж висоту, з якої почала свій рух. Якщо
є тертя, то частина енергії кулька
втратить на те, щоб подолати сили тертя.
Поступово її рух затихне. Оборотним
називається
процес,
в якому робоче тіло проходить в прямому
і зворотному напрямках через одні і ті
ж самі проміжні стани, і після цього
повертається в початковий стан без
витрати на то енергії ззовні. Необоротним
називають
процес,
в якому робоче тіло після завершення
зворотного процесу не може повернутись
в початковий стан без витрати енергії
ззовні. Для протікання оборотного
процесу необхідно виконати такі умови:
процес повинен бути рівноважним;
нескінченно повільне протікання процесу;
відсутність втрат енергії на подолання тертя;
відсутність хімічних процесів, внаслідок яких утворюються речовини з новими властивостями.
Визначення значень зміни внутрішньої енергії, ентальпії та ентропії робочого тіла при зміні його стану.
Внутрішньою енергією називається сума кінетичної і потенціальної енергії молекул газу.
u – 1 кг, Дж/кг U – m кг, Дж
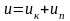
Кінетична енергія молекул визначається швидкістю руху молекул, поступального і обертального. Потенціальна енергія визначається силами щеплення між молекулами, а також розташуванням молекул у просторі. Тому для ідеального газу
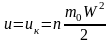 ,
,
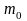 – маса
1 молекули;
– маса
1 молекули; 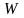 – середня
швидкість руху молекул.
– середня
швидкість руху молекул.
Для
реального газу
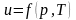 .
.
Джоуль,
вивчаючи властивості газоподібних
речовин, показав, що для ідеального газу
 і тому
і тому
 (1)
(1)
Внутрішня
енергія є параметр стану, їй притаманні
всі властивості параметрів стан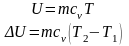
Для реального газу

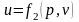
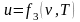
Ентальнія Розглянемо рівняння стану для 1 кг га-зу.
; ; ;
; ; ;
– повна енергія робочого тіла, або ентальпія. Це рівняння для m кг:
H=U+pV Також, як і внутрішня енергія, енталь-пія є функція тільки від температури.
Ентропія є параметр стану, і її зміна процесів знаходиться в залежності від будь-якої пари основних параметрів стану. Тобто, ентропія є функція будь-яких пара-метрів стану:



Вираз Клаузіуса говорить, що
 (1)
(1) 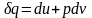 (2)
(2)
(2) підставимо в (1):
ds=du/T+pdv/T
(3)  (4)
(4)
pv=RT (5) p=RT/v (6)
 (7)
(7)
Проінтегруємо
вираз (7): 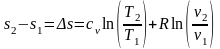 (8)
(8)
Зміна ентропії як функція (T,v).
(9)
Запишемо перший закон термодинаміки у вигляді:
 (10)
(10)
Підставимо (10) у (9): ds=dh/T-vdp/T (11)
Із
закону Джоуля ми знаємо, що: (12)
(12)
З
рівняння стану:pv=RT v=RT/p (13) (12) і (13)
підставимо в (11): 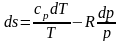 (14)
(14)
Проінтегруємо вираз (14):
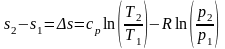 (15)
(15)
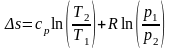 (16)
(16)
Запишемо рівняння стану для двох станів.
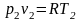 (17)
(17) 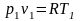 (18)
(18)
Поділимо (17) на (18):
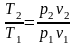 .
(19)
.
(19)
Підставимо (19) у (8):
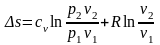 . (19)
підставимо в (15):
. (19)
підставимо в (15):
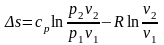 (20)
(20)
 (21)
(21)
Тоді
остаточно отримаємо: 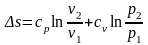 .
(22)
.
(22)
Допустимо, що ентропія під час Т=273К дорівнює нулю.
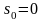 ,
,
 .
.
Припустимо,
є температура, що змінювалась від
 до
до
 .
Тоді:
.
Тоді:
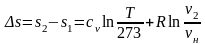
Графічний метод вивчення термодинамічних процесів. Pv та ts –діаграми та їх властивості.
І
 зотермічним
називають
процес,
який протікає під час
постійної температури.
зотермічним
називають
процес,
який протікає під час
постійної температури.
pv=RT, T=const
pv=const
У pv-діаграмі ізотермічний процес зображується як рівнобока гіпербола.
1-2 – процес розширення.
2-1
– процес стиснення.

Ізобарним називають процес, який протікає при сталому тиску.
Р=const

І зохорним
називають процес,
який протікає при сталому об’ємі.
зохорним
називають процес,
який протікає при сталому об’ємі.
v=const.
1-2 – ізобара P=const.
1-3 – ізохора V=const.

Адіабатним називають процес, який протікає без теплообміну з навколишнім середовищем.
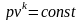
Зображення цих процесів у pv-діаграмі – нерівнобока гіпербола.
Якщо у pv-діаграмі через одну і ту ж точку проходить адіабата і ізотерма, то адіабата йде більш круто, а ізотерма – більш полого.
У
Ts-діаграмі: 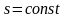 .
.
У адіабатному процесі ентропія залишається незмінною.
Політропним називають процес, у якому енергія перетворюється за наступним законом:
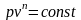 ,
n – показник політро-пи:
,
n – показник політро-пи:
 .
.
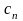 – теплоємність політропного
процесу:
– теплоємність політропного
процесу:
У залежності від значення показника політропи, всі процеси розподіляються на три групи:
0

 <n<1 k<n<∞ 1<n<k
<n<1 k<n<∞ 1<n<k

Це найневигідніші процеси.У Ts-координатах:
