
- •1. Предмет, задачи и основные понятия химической кинетики: система, фаза, процесс, механизм реакции, скорость реакции, средняя и истинная скорость химической реакции.
- •10. Влияние изменения концентрации на положение равновесия обратимой реакции. Обосновать на конкретных примерах с использованием здм.
- •12. Основные понятия и определения химической термодинамики (термодинамические системы, параметры, функции).
- •13. Первый закон т/д. Внутренняя энергия, энтальпия: определение, физический смысл.
- •14. Тепловые эффекты реакций. Применение первого закона т/д к изохорным и изобарным процессам. Стандартные энтальпии образования веществ.
- •15. Законы термохимии (Лавуазье-Лапласа, Гесса). Расчет тепловых эффектов химических процессов. Уравнение Кирхгофа.
- •16. Второй закон т/д. Энтропия системы, физический смысл. Зависимость ее от различных факторов.
- •17. Энтропия системы и ее изменение при протекании физико-химических процессов. Расчет ∆s х.Р. При стандартных условиях и заданной температуре.
- •19. Взаимосвязь энтальпийного и энтропийного факторов в определении т/д условий протекания самопроизвольных процессов.
- •20. Термодинамические условия наступления равновесия. Расчет температуры наступления равновесия. Уравнение изотермы химической реакции.
- •2 1. Уравнение изобары хим. Реакции и использование его в расчетах тепловых эффектов реакций (∆н).
- •22. Определение понятий: электролиты, электролитическая диссоциация, кислоты, основания, соли. Степень диссоциации (α), классификация электролитов по величине α.
- •23. Обратимость диссоциации слабых электролитов. Константа диссоциации. Закон разбавления Оствальда. Расчет концентраций ионов в слабом электролите.
- •24. Электролитическая диссоциация воды. Ионное произведение воды. Водородный и гидроксильный показатели.
- •25. Теория электродных потенциалов (механизм возникновения, зависимость значений от природы электродов). Электроды 1-го рода: металлические и газовые.
- •27. Электроды 1 рода (металлические и газовые). Схематическая запись, уравнения электродных реакций. Уравнение Нернста и расчет φp .
- •28. Частные случаи уравнения Нернста для расчета равновесных потенциалов газовых электродов (вывод, анализ: зависимость значений равновесных потенциалов от рН растворов).
- •29. Водородный и кислородный электроды, зависимость их значений от величины рН. Топливные водород-кислородные элементы.
- •30. Гальванические элементы: химические и концентрационные: принцип работы, основные характеристики (на конкретных примерах).
- •31. Химические гальванические элементы: Даниэля-Якоби и Вольта: принцип работы, основные характеристики.
- •32. Концентрационные гальванические элементы на конкретных примерах элементов, составленных из 2-х металлических электродов: принцип работы, основные характеристики.
- •33. Концентрационные гальванические элементы на конкретных примерах элементов, составленных из 2-х газовых электродов: принцип работы, основные характеристики.
- •34. Явление поляризации и деполяризации в гальванических элементах (на примере элемента Вольта и Даниэля-Якоби).
- •41. Явление поляризации и перенапряжение при электролизе. Потенциал (эдс) разложения. Расчет е поляр. И е разл. Электролита.
- •42. Химическая и электрохимическая коррозия металлов.
- •43. Причины и механизм электрохимической коррозии. Коррозия с водородной и кислородной деполяризацией. Факторы, влияющие на ее скорость.
- •44. Химические и электрохимические методы защиты от коррозии.
- •45. Принципиальные отличия в организации схемы и в работе г.Э.–источника тока и короткозамкнутого г.Э. Коррозии (на конкретных примерах).
- •46. Основные положения квантово-механической модели строения атома.
- •47. Квантовые числа и уравнение Шредингера. Что означает термин «волновая функция»? Каков физический смысл квадрата волновой функции?
27. Электроды 1 рода (металлические и газовые). Схематическая запись, уравнения электродных реакций. Уравнение Нернста и расчет φp .
Электроды, обратимые относительно собственных ионов в растворе электролита, называются электродами 1-го рода. Схематически эл-ды записываются в молекулярной или ионной формах. Схем. зап. и электродные реакции газ. и Me-эл-дов:
M
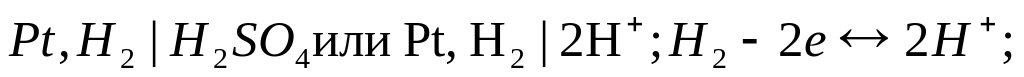 e-электрод:
e-электрод:
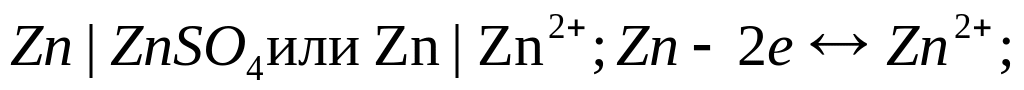
H
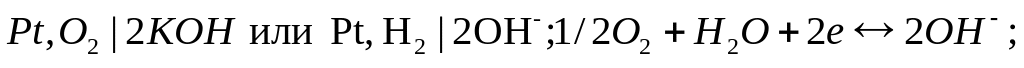 2-электрод:
2-электрод:
О2:
Ч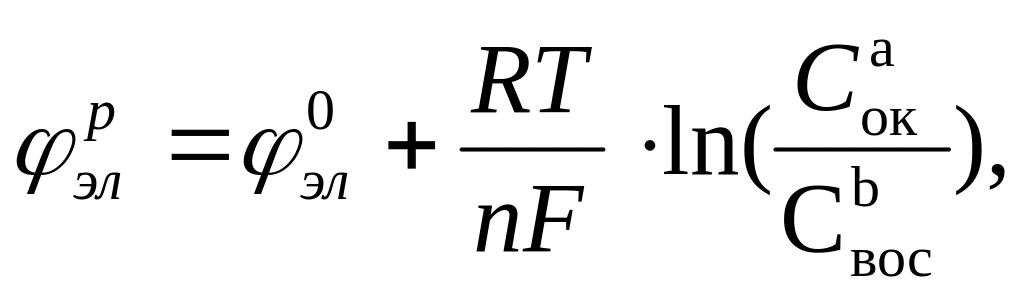 исленные
значения равновесных электродных
потенциалов (φр)
рассчитываются по уравнению Нернста:
исленные
значения равновесных электродных
потенциалов (φр)
рассчитываются по уравнению Нернста:
где Cок, Cвос – конц. ок. и восст. форм
э![]() л-дов
в степени стехиометр. коэфф., стоящих
в ур-ниях соотв. электродных реакций. В
стд. усл. ур-ние имеет вид:
л-дов
в степени стехиометр. коэфф., стоящих
в ур-ниях соотв. электродных реакций. В
стд. усл. ур-ние имеет вид:
M
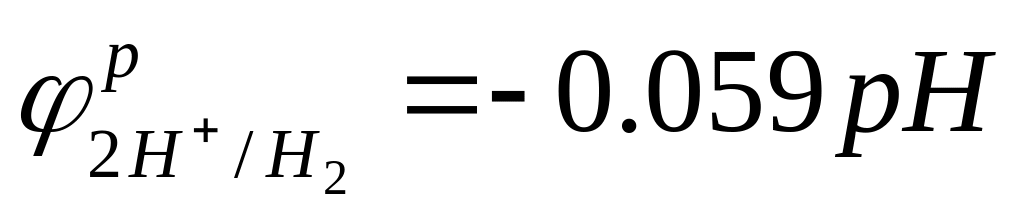 e-электрод:
e-электрод:H
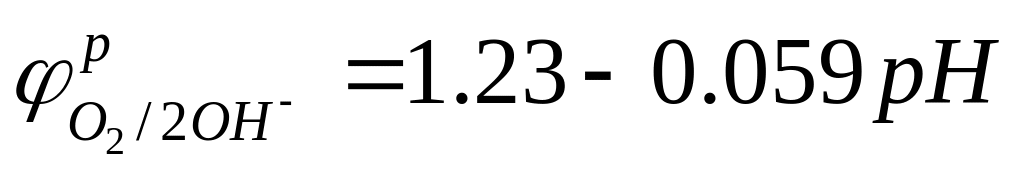 2-электрод:
2-электрод:
O2-электрод:
28. Частные случаи уравнения Нернста для расчета равновесных потенциалов газовых электродов (вывод, анализ: зависимость значений равновесных потенциалов от рН растворов).
Ч исленные значения равновесных электродных потенциалов (φр) рассчитываются по уравнению Нернста:
где Cок, Cвос – конц. ок. и восст. форм
э![]() л-дов
в степени стехиометр. коэфф. (a,b),
стоящих в ур-ниях соотв. электродных
реакций. Переходя от натурального
логарифма к десятичному (коэфф. перевода
2,3), и подставляя численные значения
постоянных R и F, при Т=298 К получим:
л-дов
в степени стехиометр. коэфф. (a,b),
стоящих в ур-ниях соотв. электродных
реакций. Переходя от натурального
логарифма к десятичному (коэфф. перевода
2,3), и подставляя численные значения
постоянных R и F, при Т=298 К получим:
H
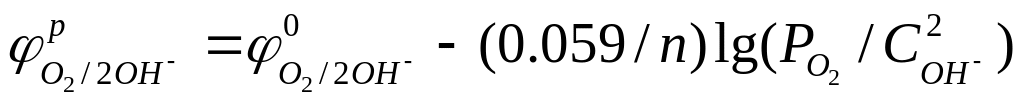 2-электрод:
2-электрод:
O2-электрод:
Принимая Pгазов за нормальные и равные 1 атм (101 кПа), n=2,
- lg(CH+)=pH, -lg(COH-)=pOH, pH+pOH=14, и подставив стандардные потенциалы H2-электрода (0В) и O2-электрода (0.4В), имеем:
H 2-электрод:
O2-электрод:
Таким образом, в стандартных условиях потенциалы газовых электродов зависят только от значения pH р-ра. Их потенциалы с увел. pH уменьшаются, растут их восст. способности.
29. Водородный и кислородный электроды, зависимость их значений от величины рН. Топливные водород-кислородные элементы.
см. бил. 28.
Топливные водород-кислородные элементы:
Топливные элементы — химические источники тока непрерывного действия, в которых окислитель и восстановитель не заложены заранее в рабочую зону, как в первичных элементах и аккумуляторах, а подаются непрерывно к электродам, которые во время работы топливного элемента не расходуются. Окислитель — чистый кислород, или кислород воздуха, иногда Cl2 , HNO3 и др. Восстановитель — водород, полученный химической конверсией различных водородсодержащих веществ: аммиака, метанола, гидридов металлов и др. Электролит — чаще всего 30%-й раствор KOH. Электроды — графитовые или пористые никелевые с добавками других металлов, катализирующих процессы. Схема кислород-водородного топливного элемента с графитовыми электродами и уравнения электродных реакций:

В![]() результате этой реакции в цепи
генерируется постоянный ток и химическая
энергия непосредственно превращается
в электрическую. ЭДС можно рассчитать
по формуле:
результате этой реакции в цепи
генерируется постоянный ток и химическая
энергия непосредственно превращается
в электрическую. ЭДС можно рассчитать
по формуле:
Реальная ЭДС элемента меньше расчетной, что обусловлено в большей степени поляризацией электродов и снижением скорости электрохимических процессов. Снижение поляризации достигается применением катализаторов, увеличением поверхности электродов (пористые), повышением температуры и давления. В высокотемпературных элементах используются твердые электролиты или расплавы солей. Для увеличения напряжения и тока элементы соединяют в батареи.
