
- •1. Предмет, задачи и основные понятия химической кинетики: система, фаза, процесс, механизм реакции, скорость реакции, средняя и истинная скорость химической реакции.
- •10. Влияние изменения концентрации на положение равновесия обратимой реакции. Обосновать на конкретных примерах с использованием здм.
- •12. Основные понятия и определения химической термодинамики (термодинамические системы, параметры, функции).
- •13. Первый закон т/д. Внутренняя энергия, энтальпия: определение, физический смысл.
- •14. Тепловые эффекты реакций. Применение первого закона т/д к изохорным и изобарным процессам. Стандартные энтальпии образования веществ.
- •15. Законы термохимии (Лавуазье-Лапласа, Гесса). Расчет тепловых эффектов химических процессов. Уравнение Кирхгофа.
- •16. Второй закон т/д. Энтропия системы, физический смысл. Зависимость ее от различных факторов.
- •17. Энтропия системы и ее изменение при протекании физико-химических процессов. Расчет ∆s х.Р. При стандартных условиях и заданной температуре.
- •19. Взаимосвязь энтальпийного и энтропийного факторов в определении т/д условий протекания самопроизвольных процессов.
- •20. Термодинамические условия наступления равновесия. Расчет температуры наступления равновесия. Уравнение изотермы химической реакции.
- •2 1. Уравнение изобары хим. Реакции и использование его в расчетах тепловых эффектов реакций (∆н).
- •22. Определение понятий: электролиты, электролитическая диссоциация, кислоты, основания, соли. Степень диссоциации (α), классификация электролитов по величине α.
- •23. Обратимость диссоциации слабых электролитов. Константа диссоциации. Закон разбавления Оствальда. Расчет концентраций ионов в слабом электролите.
- •24. Электролитическая диссоциация воды. Ионное произведение воды. Водородный и гидроксильный показатели.
- •25. Теория электродных потенциалов (механизм возникновения, зависимость значений от природы электродов). Электроды 1-го рода: металлические и газовые.
- •27. Электроды 1 рода (металлические и газовые). Схематическая запись, уравнения электродных реакций. Уравнение Нернста и расчет φp .
- •28. Частные случаи уравнения Нернста для расчета равновесных потенциалов газовых электродов (вывод, анализ: зависимость значений равновесных потенциалов от рН растворов).
- •29. Водородный и кислородный электроды, зависимость их значений от величины рН. Топливные водород-кислородные элементы.
- •30. Гальванические элементы: химические и концентрационные: принцип работы, основные характеристики (на конкретных примерах).
- •31. Химические гальванические элементы: Даниэля-Якоби и Вольта: принцип работы, основные характеристики.
- •32. Концентрационные гальванические элементы на конкретных примерах элементов, составленных из 2-х металлических электродов: принцип работы, основные характеристики.
- •33. Концентрационные гальванические элементы на конкретных примерах элементов, составленных из 2-х газовых электродов: принцип работы, основные характеристики.
- •34. Явление поляризации и деполяризации в гальванических элементах (на примере элемента Вольта и Даниэля-Якоби).
- •41. Явление поляризации и перенапряжение при электролизе. Потенциал (эдс) разложения. Расчет е поляр. И е разл. Электролита.
- •42. Химическая и электрохимическая коррозия металлов.
- •43. Причины и механизм электрохимической коррозии. Коррозия с водородной и кислородной деполяризацией. Факторы, влияющие на ее скорость.
- •44. Химические и электрохимические методы защиты от коррозии.
- •45. Принципиальные отличия в организации схемы и в работе г.Э.–источника тока и короткозамкнутого г.Э. Коррозии (на конкретных примерах).
- •46. Основные положения квантово-механической модели строения атома.
- •47. Квантовые числа и уравнение Шредингера. Что означает термин «волновая функция»? Каков физический смысл квадрата волновой функции?
1. Предмет, задачи и основные понятия химической кинетики: система, фаза, процесс, механизм реакции, скорость реакции, средняя и истинная скорость химической реакции.
Раздел химии, изучающий скорость и механизм протекания физико-химических процессов, называется химической кинетикой. Задачами химической кинетики являются: количественное описание процесса, установление факторов, влияющих на скорость реакций, установление механизма протекания реакций. Системой называют тело или совокупность 2 взаимодействующих тел, реально или мысленно выделенные в пространстве и способные обмениваться с окружающей средой или между собой энергией и (или) веществом. Часть системы, однородная во всех точках по составу, физическим и химическим свойствам и отделенная от других частей системы поверхностью, называется фазой. В зависимости от числа фаз различают гомогенные системы, состоящие из одной фазы, и гетерогенные — из двух или нескольких фаз. Изменение хотя бы одного из параметров состояния системы называется процессом. Механизм реакции – совокупность всех стадий, через которые происходит превращение исходных вещ-в в продукты реакции. Скорость реакции – число элементарных взаимодействий в единицу времени в единице реакционного пространства. Реакционным пространством в гомогенной системе служит объем сосуда, в котором происходит взаимодействие, в гетерогенной — поверхность раздела фаз. Средняя скорость реакции – изменение кол-ва вещества в единицу времени в единице реакционного пространства. Истинная (=мгновенная) скорость реакции – производная концентрации по времени.
1.2 Скорость гомогенных и гетерогенных процессов. Многостадийность гетерогенных процессов. Факторы, влияющие на скорость реакций. Основные кинетические законы и правила.
Скорость
гомогенных и гетерогенных
процессов (по выбранному компоненту)
выражается формулами:
![]() Скорость реакции зависит от: природы
реаг. вещ-в, условий
протекания реакции (p,V,T),
присутствия катализаторов, величины
реагирующей поверхности (для гетер.
реакций). Реакции в гетерогенных системах,
как правило, отличаются сложностью и
протекают по стадиям:
Скорость реакции зависит от: природы
реаг. вещ-в, условий
протекания реакции (p,V,T),
присутствия катализаторов, величины
реагирующей поверхности (для гетер.
реакций). Реакции в гетерогенных системах,
как правило, отличаются сложностью и
протекают по стадиям:
1. процесс переноса исходных веществ к поверхности раздела фаз;
2. адсорбция исходных веществ на границе раздела фаз;
3. непосредственно сама химическая реакция;
4. десорбция продуктов реакции;
5. отвод продуктов реакции от поверхности раздела фаз.
Ввиду того, что эти стадии протекают последовательно, скорость процесса определяется самой медленной стадией (лимитирующей).
Основными кинетическими законами и правилами являются ЗДМ, правило Вант-Гоффа, уравнение Аррениуса.
3. Зависимость скорости химических реакций от концентраций (парциальных давлений) реагирующих веществ. Закон действия масс для гомогенных и гетерогенных реакций. Константа скорости.
Необходимым условием осуществления химического взаимодействия является столкновение реагирующих частиц. Столкновение их в некотором реакционном пространстве при заданной температуре происходит тем чаще, чем больше этих частиц. Эта зависимость выражается основным законом химической кинетики — ЗДМ: скорость гомогенной химической реакции при постоянной температуре прямо пропорциональна произведению концентраций (парциальных давлений) реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
![]() Константа
скорости – показывает, с какой скоростью
идет реакция при концентрациях вещ-в,
равных 1 моль/л (физич. смысл). Также, k
является количественной мерой реакционной
способности молекул (хим. смысл). Зависит
от природы вещ-в, T,
катализаторов. ЗДМ применим только для
простых реакций. Но если в гетерогенной
реакции лимитирующей стадией является
сама реакция, то ЗДМ лим. стадии применим
ко всей реакции, с учетом ограничения:
концентрации тв. вещ-в постоянны и
включены в k
,
поэтому в ур-ние ЗДМ входят только конц.
газообразных и жидких вещ-в.
Константа
скорости – показывает, с какой скоростью
идет реакция при концентрациях вещ-в,
равных 1 моль/л (физич. смысл). Также, k
является количественной мерой реакционной
способности молекул (хим. смысл). Зависит
от природы вещ-в, T,
катализаторов. ЗДМ применим только для
простых реакций. Но если в гетерогенной
реакции лимитирующей стадией является
сама реакция, то ЗДМ лим. стадии применим
ко всей реакции, с учетом ограничения:
концентрации тв. вещ-в постоянны и
включены в k
,
поэтому в ур-ние ЗДМ входят только конц.
газообразных и жидких вещ-в.
4. Влияние температуры на скорость процессов. Правило Вант-Гоффа. Температурный коэффициент реакции (γ). Уравнение Аррениуса.
Увеличение скорости химической реакции с повышением температуры связано с возрастанием числа молекул, обладающих избыточной энергией. Для того, чтобы произошла реакция, т.е. чтобы образовались новые молекулы необходимо вначале разорвать или ослабить связи между атомами исходных веществ. На это необходимо затратить определенную энергию. Если сталкивающиеся частицы будут обладать такой энергией, что столкновение их может привести к перестройке атомов и к образованию молекул нового вещества. Зависимость скорости физико-химического процесса от температуры приближенно выражается правилом Вант-Гоффа: при увеличении температуры на каждые 10°С скорость химической реакции возрастает примерно в 2 – 4 раза. Математически эта зависимость выражается соотношением:
![]() Темп. коэфф.
показывает, во сколько раз возр. скорость
реакции при пов. темп. на 10 С (физич.
смысл). Зависит от прир. вещ-в и присутствия
катализатора.
Темп. коэфф.
показывает, во сколько раз возр. скорость
реакции при пов. темп. на 10 С (физич.
смысл). Зависит от прир. вещ-в и присутствия
катализатора.
Точная
зависимость скорости реакции от
температуры задается ур-нием Аррениуса:
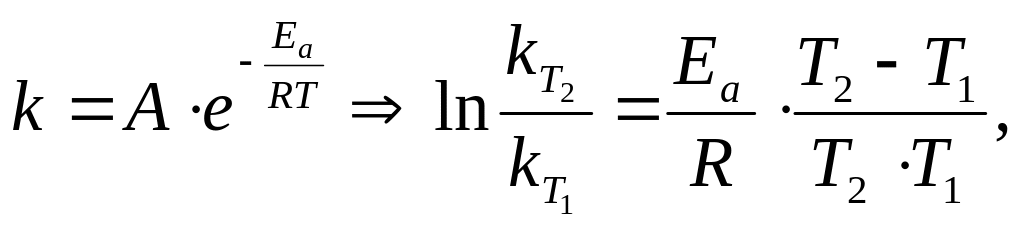
где k — константа скорости;
Еa — энергия активации, кДж/моль;
R — универсальная газовая постоянная, 8,314 Дж/моль⋅ К;
Т — абсолютная температура, К;
е — основание натурального логарифма;
А — предэкспоненциальный множитель (постоянная величина для данной реакции).
5. Энергия активации процесса. Уравнение Аррениуса. Анализ уравнения Аррениуса.
Избыточная
энергия, которой должны обладать
молекулы, чтобы столкновение было
эффективным, называется энергией
активации (Ea),
а частицы, обладающей такой энергией,
называются активными. С повышением
температуры по
экспоненциальному закону возрастает
доля активных частиц
(![]() ).
Числовое
значение множителя
определяет отношение фактической
скорости реакции при заданной темп. и
ед. конц. к макс. возможной (физический
смысл). Чем больше Ea,
тем меньше скорость реакции, но при
этом, с увеличением T,
в большей степени возрастает скорость
тех реакций, Ea
которых больше. Величина Ea
определяет высоту энергетического
барьера реакции, а ее уменьшение с
помощью катализатора является одним
из способов увеличения скорости реакции.
).
Числовое
значение множителя
определяет отношение фактической
скорости реакции при заданной темп. и
ед. конц. к макс. возможной (физический
смысл). Чем больше Ea,
тем меньше скорость реакции, но при
этом, с увеличением T,
в большей степени возрастает скорость
тех реакций, Ea
которых больше. Величина Ea
определяет высоту энергетического
барьера реакции, а ее уменьшение с
помощью катализатора является одним
из способов увеличения скорости реакции.
Ур-ние Аррениуса позволяет рассчитать:
как изменится v реакции при известном ΔT и Ea;
Ea, зная v и ΔT;
6. Энергетические диаграммы реакций, активированный комплекс. Влияние катализаторов на скорость химических реакций.
Величина Ea определяет высоту энергетического барьера реакции. Преодоление этого барьера частицами исходных вещ-в связано с образованием акт. комплекса. Акт. комп. – группа взаимод. ч-ц в момент соударения: старые связи ослабли, а новые еще не образовались. Эн. диагр. реакции – опис. хода реакции через изменение эн-гии исх. вещ-в. На рис. эн. диагр. экзотерм. реакции:
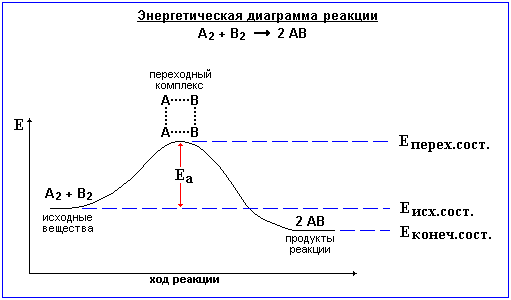
![]()
Катализаторы — вещества, которые, участвуя в реакции и влияя на её скорость, сами к концу её остаются химически неизменными. Могут как ускорять, так и замедлять реакцию (ингибиторы). Введение в систему катализатора разбивает процесс на несколько промежуточных стадий, Ea которых меньше, чем Ea всего процесса.
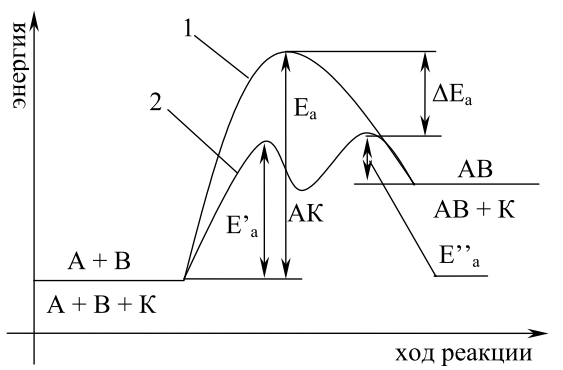


7. Обратимые процессы. Химическое равновесие (кинетическое условие равновесия и факторы, влияющие на его состояние). Вывод константы равновесия.
О![]() братимые
процессы
– процессы, протекающие при данных
условиях одновременно в двух противоположных
направлениях, при этом ни одно из
реагирующих вещ-в не расходуется
полностью. В закрытых системах при
T=p=const
обратимые реакции протекают до состояния
равновесия. Хим.
равновесие
– состояние обр. процесса, при котором
vпр=vобр.
Х.Р. нарушается при изменении p,
T,
C.
Вывод KC:
братимые
процессы
– процессы, протекающие при данных
условиях одновременно в двух противоположных
направлениях, при этом ни одно из
реагирующих вещ-в не расходуется
полностью. В закрытых системах при
T=p=const
обратимые реакции протекают до состояния
равновесия. Хим.
равновесие
– состояние обр. процесса, при котором
vпр=vобр.
Х.Р. нарушается при изменении p,
T,
C.
Вывод KC:

где - равновесная концентрация вещ-ва, моль/л.
8. Константа химического равновесия (КC и КP , их взаимосвязь). Физический смысл. Факторы, влияющие на численное значение. Зависимость КC и КP от температуры.
Для газообразных систем вместо концентраций можно использовать равновесные парциальные давления газов:
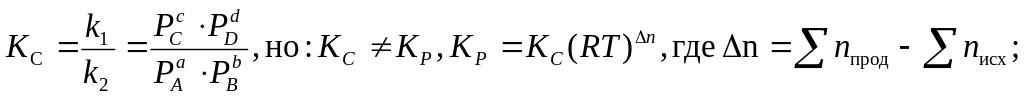
Физический
смысл КC
(КP
) : константа равновесия определяет
предел (глубину) протекания процесса
в выбранном направлении, показывая,
какие вещества (исходные или продукты
реакции) преобладают в равновесной
системе. Если К>1, равновесие смещено
вправо, т. е. в равновесной системе
преобладают продукты реакции, и наоборот,
при К<1 — равновесие смещено влево,
преобладают исходные вещества. Численное
значение КC
(КP
) зависит от природы реагирующих
веществ, температуры и не зависит от
концентраций (парциальных давлений) и
присутствия катализатора. Зависимость
константы равновесия от температуры
выражается уравнением изобары (для Р,
Т = const):
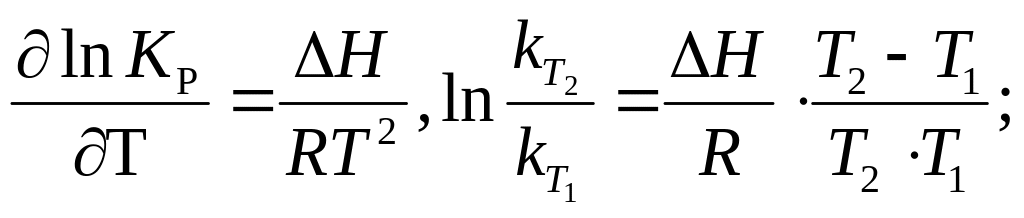
С повышением температуры константа равновесия увеличивается в эндотермических реакциях и уменьшается в экзотермических реакциях.
9. Кинетическое условие наступления равновесия в системе, условия его сохранения и смещения. Принцип Ле-Шателье.
Условие наст. равн.: vпр=vобр. Равновесие смещается при изменении C, P, T, при которых система находилась в равновесии.
Принцип Ле Шателье: если на систему, находящуюся в состоянии равновесия, оказывается воздействие (изменяются концентрация, температура, давление), то оно благоприятствует той из двух противоположных реакций, которая ослабляет это воздействие. Например:
При увеличении концентрации исходных веществ равновесие смещается в сторону продуктов реакции и наоборот.
При повышении давления равновесие смещается в сторону той реакции, которая сопровождается уменьшением давления, т. е. в сторону образования меньшего числа молей газообразных веществ. Если реакция идет без изменения объема, то изменение давления не вызывает смещения химического равновесия.
Повышение температуры смещает равновесие в сторону протекания эндотермического процесса (∆Н>0), а понижение — в сторону экзотермической реакции (∆Н<0).
