
- •Структура Периодической системы элементов:
- •Вопрос 31. Типы химических связей и физико-химические свойства соединений с ковалентной, ионной и металлической связью. Экспериментальные характеристики связей: энергия связи, длина, направленность.
- •Механизмы образования ковалентных связей
- •Пространственное расположение атомов в молекулах.
- •Метод основан на следующих положениях:
- •Вопрос 35. Межмолекулярные взаимодействия и их природа. Энергия межмолекулярного взаимодействия. Ориентационное, индукционное и дисперсионное взаимодействие.
- •Энергия межмолекулярного взаимодействия:
- •Ориентационное взаимодействие
- •Дисперсионное взаимодействие
Пространственное расположение атомов в молекулах.
Тип гибридизации |
Геометрическая форма |
Угол между связями |
sp |
линейная |
180o |
sp2 |
треугольная |
120o |
sp3 |
тетраэдрическая |
109,5o |
sp3d |
тригонально-бипирамидальная |
90o; 120o |
sp3d2 |
октаэдрическая |
90o |
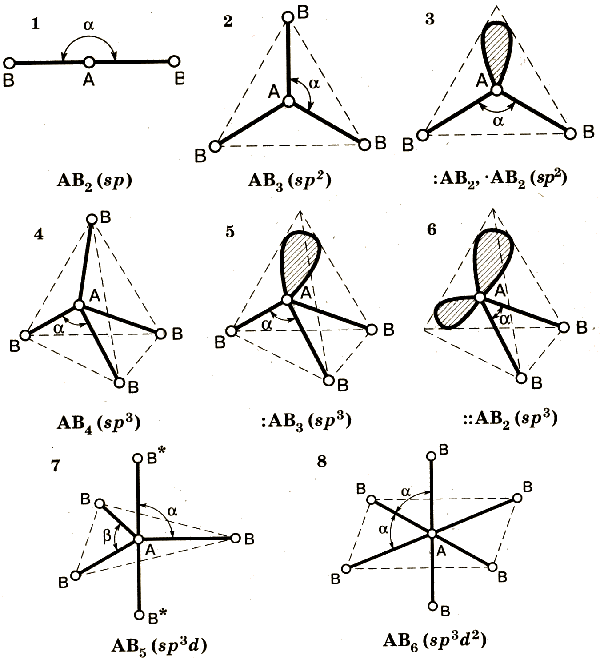
Это все, что я нашла по 33 вопросу. Извиняйте.
Вопрос 34. Описание молекул методом молекулярных орбиталей (ММО). Связывающие, разрыхляющие или не связывающие МО, их энергия и форма. Энергетические диаграммы МО. Заполнение МО электронами в молекулах.
Теория молекулярных орбиталей (МО) дает представление о распределении электронной плотности и объясняет свойства молекул
Метод основан на следующих положениях:
1. При сближении атомов до расстояний химических связей из атомных орбиталей (АО) образуются молекулярные.
2. Число полученных молекулярных орбиталей равно числу исходных атомных.
3. Перекрываются атомные орбитали, близкие по энергии. В результате перекрывания двух атомных орбиталей образуются две молекулярные. Одна из них имеет меньшую энергию по сравнению с исходными атомными и называется связывающей, а вторая молекулярная орбиталь обладает большей энергией, чем исходные атомные орбитали, и называется разрыхляющей.
4. При перекрывании атомных орбиталей возможно образование и сигма -связи (перекрывание по оси химической связи), и пи -связи (перекрывание по обе стороны от оси химической связи).
5. Молекулярная орбиталь, не участвующая в образовании химической связи, носит название несвязывающей. Ее энергия равна энергии исходной АО.
6. На одной молекулярной орбитали (как, впрочем, и атомной) возможно нахождение не более двух электронов.
7. Электроны занимают молекулярную орбиталь с наименьшей энергией (принцип наименьшей энергии).
8. Заполнение вырожденных (с одинаковой энергией) орбиталей происходит последовательно по одному электрону на каждую из них.
Молекулярная орбиталь, энергия которой меньше энергии атомной орбитали изолированного атома, называется связывающей , а находящиеся на ней электроны—связывающими электронами.
Молекулярная орбиталь, энергия которой больше энергии атомной орбитали, называется антисвязывающей или разрыхляющей, а находящиеся на ней электроны — разрыхляющими электронами.
Далее мысленно перекроем две атомные орбитали, образовав две молекулярные, одна из которых (связывающая) обладает меньшей энергией (расположена ниже), а вторая (разрыхляющая) – большей энергией (расположена выше)
Если у соединяющихся атомов водорода спины электронов антипараллельны, то они займут связывающую МО, возникает химическая связь (рис. 12), сопровождающаяся выделением энергии E1 (435 кДж/моль). Если же спины электронов атомов водорода параллельны, то они в соответствии с принципом Паули не могут разместиться на одной молекулярной орбитали: один из них разместится на связывающей, а другой на разрыхляющей орбитали, значит химическая связь образоваться не может.
Согласно методу МО образование молекул возможно, если число электронов на связывающих орбиталях больше числа электронов на разрыхляющих орбиталях. Если же число электронов на связывающих и разрыхляющих орбиталях одинаково, то такие молекулы образоваться не могут. Так, теория не допускает существования молекулы Нe2, так как в ней два электрона находились бы на связывающей орбитали и два — на разрыхляющей. Всегда разрыхляющий электрон сводит на нет действие связывающего электрона.
С помощью энергетических диаграмм определяются энергии связывающих и разрыхляющих молекулярных орбиталей. Если переход двух электронов на связывающую молекулярную орбиталь способен компенсировать ее потери при переходе двух других электронов на разрыхляющую молекулярную орбиталь, то такая частица может существовать, а противном случае существование частицы невозможно.
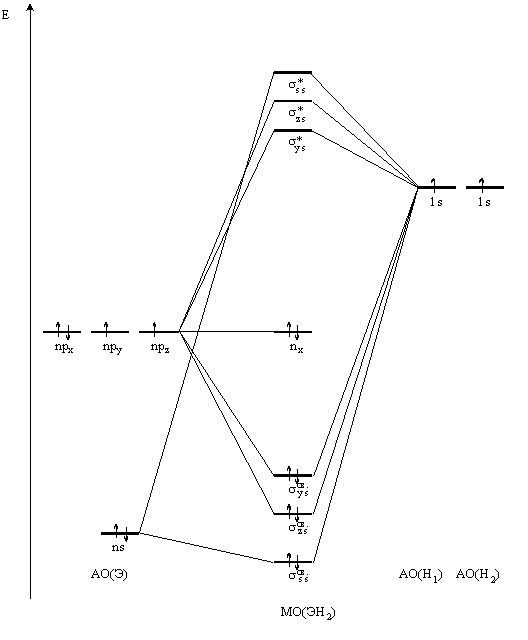
Полученные МО заполняются электронами по правилам:
1. МО заполняются электронами в порядке возрастания их энергии.
2. На каждой МО может находиться не более двух электронов с антипараллельными спинами (принцип Паули).
3. МО с одинаковыми энергиями вначале последовательно заполняются электронами с параллельными спинами, оставшиеся электроны располагают на этих же МО с противоположным спином (правило Гунда).
