
- •3. Открытой системой называется такая система, которая может обмениваться со средой как веществом, так и энергией (∆m≠0, ∆e≠0) – пример: живая клетка
- •Вопрос 3 Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами.
- •Вопрос 4
- •Вопрос 5
- •Вопрос 6
- •Вопрос 7
- •8 Вопрос
- •Суть теории переходного состояния (активированного комплекса):
- •Теория переходного состояния
- •9 Вопрос
- •Понижение температуры кристаллизации растворов
- •Повышение температуры кипения растворов
- •Криоскопическая и эбулиоскопическая константы
- •15. Кондуктометрия. Использование кондуктометрических измерений в медицине и биологии.
- •17. Растворимость газов в жидкостях и её зависимость от различных факторов. Законы Генри и Дальтона. Влияние электролитов на растворимость газов. Закон Сеченова.
- •18. Протолитические реакции. Ионизация слабых кислот и оснований. Константа кислотности и основности. Связь между константой кислотности и константой основности в сопряженной протолитической паре.
- •19. Гидролиз солей. Степень и константа гидролиза
- •Степень гидролиза
- •20. Буферное действие – основной механизм протолитического гомеостаза в организме. Механизм действия буферных систем. Зона буферного действия и буферная ёмкость. Расчёт рН буферных систем.
- •21 Вопрос
- •22 Вопрос
- •25 Константы нестойкости комплексных ионов
Понижение температуры кристаллизации растворов
Разность между температурой кристаллизации растворителя T°fr и температурой начала кристаллизации раствора Tfr есть понижение температуры кристаллизации.
Понижение температуры кристаллизации бесконечно разбавленных растворов не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора.
![]()
Поскольку по мере кристаллизации растворителя из раствора концентрация последнего возрастает, растворы не имеют определённой температуры замерзания и кристаллизуются в некотором интервале температур.
Повышение температуры кипения растворов
Жидкость кипит при той температуре, при которой общее давление насыщенного пара становится равным внешнему давлению. Если растворённое вещество нелетуче (то есть давлением его насыщенных паров над раствором можно пренебречь), то общее давление насыщенного пара над раствором равно парциальному давлению паров растворителя. В этом случае давление насыщенных паров над раствором при любой температуре будет меньше, чем над чистым растворителем, и равенство его внешнему давлению будет достигаться при более высокой температуре. Таким образом, температура кипения раствора нелетучего вещества Tb всегда выше, чем температура кипения чистого растворителя при том же давлении T°b.
Повышение температуры кипения бесконечно разбавленных растворов нелетучих веществ не зависит от природы растворённого вещества и прямо пропорционально моляльной концентрации раствора
![]()
Криоскопическая и эбулиоскопическая константы
Коэффициенты пропорциональности К и Е в приведённых выше уравнениях — соответственно криоскопическая и эбулиоскопическая постоянные растворителя, имеющие физический смысл понижения температуры кристаллизации и повышения температуры кипения раствора с концентрацией 1 моль/кг. Для воды они равны 1.86 и 0.52 K·моль−1·кг соответственно. Поскольку одномоляльный раствор не является бесконечно разбавленным, второй закон Рауля для него в общем случае не выполняется, и величины этих констант получают экстраполяцией зависимости из области малых концентраций до m = 1 моль/кг.
Для водных растворов в уравнениях второго закона Рауля моляльную концентрацию иногда заменяют молярной. В общем случае такая замена неправомерна, и для растворов, плотность которых отличается от 1 г/см³, может привести к существенным ошибкам.
Второй закон Рауля даёт возможность экспериментально определять молекулярные массы соединений, неспособных к диссоциации в данном растворителе; его можно использовать также для определения степени диссоциации электролитов.
.
Законы Рауля не выполняются для растворов
(даже бесконечно разбавленных), которые
проводят электрический ток — растворов
электролитов.
Для учёта этих отклонений Вант-Гофф внёс
в приведённые выше уравнения
поправку — изотонический
коэффициент,
неявно учитывающий диссоциацию молекул
растворённого вещества:
![]() ;
; ![]()
Неподчинение растворов электролитов законам Рауля и принципу Вант-Гоффа послужили отправной точкой для создания С. А. Аррениусом теории электролитической диссоциации
Для любого слабого электролита MA процесс диссоциации можно представить в виде уравнения:
MA ![]() M+ +
A-.
M+ +
A-.
 .
.
Данная константа является константой диссоциации слабого электролита. Она не зависит от исходной концентрации веществ, а зависит только от природы электролита и растворителя, а также от температуры. Константа диссоциации характерна только для слабых электролитов. Чем больше значение константы, тем сильнее электролит подвержен диссоциации.
Закон разбавления Оствальда — соотношение, выражающее зависимость эквивалентной электропроводности разбавленного раствора бинарного слабого электролита от концентрации раствора:
![]()
Здесь К — константа диссоциации электролита, с — концентрация, λ и λ∞ — значения эквивалентной электропроводности соответственно при концентрации с и при бесконечном разбавлении. Соотношение является следствием закона действующих масс и равенства
![]()
где α — степень диссоциации.
13. Элементы теории растворов электролитов. Сильные и слабые электролиты. Активность и коэффициент активности ионов. Электролиты в организме.
Электроли́ты — вещества, расплавы или растворы, которые проводят электрический ток вследствие диссоциации на ионы, однако сами вещества не проводят электрический ток. Примерами электролитов могут служить растворы кислот, солей и оснований. Электролиты — проводники второго рода, вещества, которые в растворе (или расплаве) состоят полностью или частично из ионов, и обладающие вследствие этого ионной проводимостью
Сильные электролиты — электролиты, степень диссоциации которых в растворах равна единице (то есть диссоциируют полностью) и не зависит от концентрации раствора. Сюда относятся подавляющее большинство солей, щелочей, а также некоторые кислоты (сильные кислоты, такие как: HCl, HBr, HI, HNO3).
Слабые электролиты — степень диссоциации меньше единицы (то есть диссоциируют не полностью) и уменьшается с ростом концентрации. К ним относят воду, ряд кислот (слабые кислоты), основания p-, d-, и f- элементов.
Между этими двумя группами четкой границы нет, одно и то же вещество может в одном растворителе проявлять свойства сильного электролита, а в другом — слабого.
Активность компонентов раствора — эффективная (кажущаяся) концентрация компонентов с учетом различных взаимодействий между ними в растворе, то есть с учетом отклонения поведения системы от модели идеального раствора.
Активность
отличается от общей концентрации на
некоторую величину. Отношение активности
(![]() )
к общей концентрации вещества в растворе
называется коэффициентом
активности:
)
к общей концентрации вещества в растворе
называется коэффициентом
активности:
![]()
Основные электролиты в организме - натрий, калий, кальций, магний, хлор.
14. Электрическая проводимость растворов. Жидкости и ткани организма как проводники электричества второго рода. Удельная электрическая проводимость раствора, молярная электрическая проводимость электролита; их изменение с концентрацией раствора. Электрическая подвижность ионов. Предельная молярная электрическая подвижность. Закон Кольрауша.
Электрическая проводимость — способность вещества проводить электрический ток под действием электрического поля.
К проводникам второго рода относятся соли и щелочи в кристаллическом, растворенном или расплавленном состоянии, также растворы кислот и оснований в воде и в некоторых других растворителях.
Согласно теории электролитической диссоциации, молекулы солей, кислот и щелочей при переходе в водные растворы диссоциируют, т. е. распадаются на электрически заряженные частицы — ионы. Благодаря наличию в растворе положительно заряженных частиц — катионов и отрицательно заряженных частиц — анионов раствор приобретает свойство проводимости электричества. Такие электропроводные растворы носят название электролитов.
При пропуске постоянного электрического тока через электролит перенос электричества в последнем происходит за счет перемещения ионов, причем анионы движутся к положительному полюсу, а катионы к отрицательному. В отличие от электронной проводимости, присущей проводникам первого рода, проводимость электролитов представляет собой ионную проводимость.
Следовательно, жидкости и ткани организма проводники электричества второго рода.
Удельной
электропроводностью называется
электропроводность раствора, заключенного
между электродами с поперечным сечением
в 1см2 и
находящимися на расстоянии 1 см друг от
друга. Удельная электропроводность χ (каппа)
равна величине, обратной удельному
сопротивлению ![]() ,
т.е. сопротивлению 1см3 проводника:
,
т.е. сопротивлению 1см3 проводника:
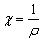 [ом-1 см-1 ]
[ом-1 см-1 ]
Удельную электропроводность исследуемого раствора вычисляют по уравнению:

Удельная электропроводность увеличивается с увеличением концентрации ионов в растворе.
Молярная электропроводность - это электрическая проводимость плоского слоя раствора электролита толщиной 1 см, содержащего 1 моль растворенного вещества, (эта величина обозначается греческой буквой λ). Зная удельную электропроводность, можно рассчитать молярную электропроводность по несложной формуле: λ = 1000•κ/C, где C - концентрация раствора, моль/л; κ - удельная электропроводность Ом-1см-1.
Молярная электропроводность уменьшается с увеличением концентрации ионов в растворе.
Электрическая
подвижность иона ![]() —
это скорость движения i-иона vi в
электрическом поле с напряженностью
—
это скорость движения i-иона vi в
электрическом поле с напряженностью ![]() В/м,
В/м,
![]() ,
,
где U — напряжение, поданное на электроды, l — расстояние между электродами, ui — подвижность i-иона, м2× В–1 · с–1; vi — скорость движения i-иона, м/с.
Предельная
эквивалентная (молярная) электропроводимость (![]() )
– это значение эквивалентной
электропроводимости, которое не зависит
от разведения. При бесконечном разведении
эквивалентная электропроводимость
определяется по закону
Кольрауша: при
бесконечно большом разбавлении ионы
движутся независимо друг от друга, и
общая электропроводимость раствора
электролита равна сумме электропроводимостей
катиона и аниона.
)
– это значение эквивалентной
электропроводимости, которое не зависит
от разведения. При бесконечном разведении
эквивалентная электропроводимость
определяется по закону
Кольрауша: при
бесконечно большом разбавлении ионы
движутся независимо друг от друга, и
общая электропроводимость раствора
электролита равна сумме электропроводимостей
катиона и аниона.
Закон Кольрауша (или закон аддитивности электропроводности при бесконечном разбавлении электролитов) гласит, что в бесконечно разбавленном растворе перенос электричества осуществляется всеми ионами независимо друг от друга; при этом общая молярная электропроводность раствора равна сумме молярных электропроводностей отдельных ионов. Закон был экспериментально установлен в 1879 году В. Кольраушем, позже получил объяснение исходя из теории электролитической диссоциации. При увеличении концентрации растворов увеличивается взаимодействие между ионами и закон Кольрауша не выполняется.
