
- •1.История развития стеклоделия.
- •2. Основы технологии стекла, ситаллов и эмали.
- •2.Стекло, стеклообразное состояние.
- •3. Строение стекла.
- •4. Кристаллохимическое описание строения стекла.
- •5. Кварцеваое стекло.
- •6. Бинарные щелочно-силикатные стекла системы Ме20—SiO2 .
- •7. Стекла в системах Ме20—МеО—SiO2.
- •8. Щелочно-алюмосиликатные стекла.
- •9.Валентно-химическое описание строения стекла.
- •10. Химическая связь в стеклах, в соответствии с электронной теорией.
- •11.Теория валентных связей и структура стекол.
- •12. Теория молекулярных орбиталей и цветность стекла.
- •13. Зонная теория.
- •14. Свойства расплавов стекол.
- •14. Кристаллизационная способность.
- •15. Вязкость.
- •16. Поверхностное натяжение
- •17. Свойства стекол в твёрдом состоянии.
- •17. Физические свойства стекла.
- •18. Теплофизические свойства стекла.
- •19 Влияние состава стекла на тклр.
- •20. Оптические свойства
- •21 Электрофизические свойства.
- •22 Химическая стойкость стекол
- •23 Классификация стекол, их составы и области применения
- •23Элементарные, галогенидные и халькогенидные стекла
- •24Оксидные стекла
6. Бинарные щелочно-силикатные стекла системы Ме20—SiO2 .
(Me-Li-Na-K-Rb-Cz-Tn).
Введение в состав стекла оксидов щелочных металлов приводит к разрыву структурной сетки и встраиванию атомов щелочных металлов по месту разрыва по схеме:
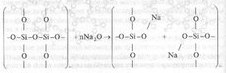
В том месте, где встраивались ионы щелочного металла, отсутствует химическая связь между элементами структуры. По мере увеличения концентрации Ме20 — модификатора в составе стекла растет число разрывов в структурной сетке и число немостиковых атомов кислорода, приходящихся на один тетраэдр SiO44-. При концентрациях Ме20 более 60% (по массе) создаются условия для образования изолированных тетраэдров SiO44- . Кристаллизуются подобные расплавы чрезвычайно быстро, т.к. облегчаются условия переориентации структурных единиц, в то время как застывание расплава в виде стекла при этом затруднено.
Структурным параметром, позволяющим характеризовать протяженность кремнекислородного радикала и тип анионной сетки, является степень связности fSi, выражающаяся отношением числа атомов кремния к числу атомов кислорода, взятых по молекулярному составу стекла, т.е. fSi = [Si]/[0]. Максимальная степень связности сетки характерна для кварцевого стекла fSi = 0,5.
Изменение степени связности структурной сетки приводит к изменению кремнекислородного радикала и типа структуры.
7. Стекла в системах Ме20—МеО—SiO2.
Катионы щелочноземельных металлов в структуре стекла выполняют роль модификаторов, т.е. выбывают разрыв структурной сетки, встраиваясь в свободные полости. При замещении щелочных катионов на щелочноземельные степень связности структурной сетки может несколько возрасти, т.к. щелочноземельные ионы, обладая более высоким зарядом, могут связывать отдельные кремнекислородные цепочки.
Роль катионов в структуре стекла и их влияние на свойства определяются следующими параметрами: зарядом и радиусом иона, координационным числом, поляризуемостью и поляризующей способностью, ионным потенциалом, силой поля катиона, степенью ионности или ковалентности связи, направленностью и прочностью химической связи.
8. Щелочно-алюмосиликатные стекла.
Структурная роль алюминия (Al) в стекле идентична его роли в кристаллических алюмосиликатах, т.е. катионы А13+ могут находиться в четверной или шестерной координации по кислороду и образовывать координационные тетраэдры типа А104 (тетраэдры) и А106 (октаэдры).
Условием существования алюминия в том или ином координационном состоянии в силикатных стеклах является соотношение между концентрацией щелочных (или щелочноземельных) оксидов и оксида А1203. При соотношениях Ме20/А1203>1 А13+ присутствует в стекле в тетраэдрическом окружении. Следует обратить внимание на то, что группировка [А104]5- в силикатных стеклах не существует самостоятельно. Она устойчива только в том случае, если вблизи тетраэдра [А104]5- расположен ион щелочного металла, например, натрия. Стабильной в этом случае является не просто группировка [А104]5- а группа атомов [(А104)5-На+]4- , в которой ион натрия не связан с каким-либо определенным атомом кислорода, а локализован на тетраэдре [А104]5- частично компенсируя отрицательный заряд анионной группировки.
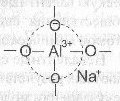
Атомы кислорода в вершинах тетраэдра А104 в этом случае являются мостиковыми и могут принимать участие в образовании химической связи с кремнекислородными тетраэдрами. Как и в кристаллических силикатах, тетраэдрические группировки алюминия могут, наравне с тетраэдрами SiO4, участвовать в построении структурного каркаса стекла, сочленяясь с ними вершинами. Образуется смешанная алюмокремнекислородная сетка.
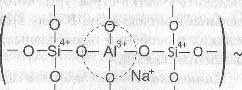
При введении оксида алюминия в щелочно-силикатное стекло повышается степень связности структурной сетки, т.к. он встраивается в кремне-кислородный каркас и наряду с этим изменяет структурную роль щелочного компонента.
Наиболее благоприятные возможности для изоморфного замещения ионов кремния на ионы алюминия создаются в присутствии катионов №+, К+, Са2+.
Существование алюминия в стеклах в шестерной координации наиболее вероятно в бесщелочных и малощелочных составах с выраженным кислотным характером. Щелочноземельные катионы малого радиуса Ве2+, Мg2+ способствуют стабилизации в стекле алюминия, являющегося модификатором.
