
- •Занятие № 11. Цитоскелет.
- •1. Промежуточные филаменты (пф).
- •1.1. Особенности строения эпителиальных кератинов.
- •1.2. Функции эпителиальных промежуточных филаментов.
- •1.3. Формирование промежуточных филаментов. Образование цитоплазматической сети.
- •1.4. Динамика и регуляция работы кератинов. Связь с клеточным циклом.
- •1.5. Кератиновые болезни.
- •1.6. Особенности строения и функций кератинов 8 и 18.
- •1.7. Кератины 8/18, апоптоз, клеточный цикл, протоонкогены.
- •2. Микрофиламенты.
- •2.1. Актин.
- •2.2. Актин-связывающие белки.
- •Г лобулярные белки.
- •П алочковидные белки.
- •Нитевидные белки.
- •Другие сшивающие белки.
- •2.3. Миозин.
- •2.3.1. Миозин II.
- •2.3.2. Миозин I.
- •2.3.3. Регуляция актомиозинового взаимодействия.
- •3. Микротрубочки (мт).
- •3.1. Полимеризация тубулина. Динамическая нестабильность.
- •3 .2. Белки, ассоциированные с мт.
- •3.3. Белки-транслокаторы.
- •3.3.1. Кинезиноподобные белки.
- •3.3.2. Динеиноподобные белки.
- •3.4. Антимитотические агенты.
- •4. Процесс распластывания.
- •4.1. Стадии распластывания.
- •4.2. Распластывание. Мт и пф.
- •5. Клеточный центр.
- •5.1. Структура и функции центриолей и центросомы.
- •5.2. Биохимические особенности центриоли и центросомы.
- •5.3. Нарушения в строении и функционировании центросомы. Роль центросомы в формировании злокачественных опухолей.
- •6. Препараты и эмф.
- •6.1. Цитоскелет.
- •Цитоскелет в первичных фибробластах. Препарат.
- •Цитоскелет в фибробласте. Эмф.
2.2. Актин-связывающие белки.
Этим названием объединяют группу белков, способных взаимодействовать с актином. Они очень многочисленны и разнообразны. В зависимости от выполняемых ими функций, актин-связывающие белки подразделяют на несколько групп.
Белки, ингибирующие полимеризацию актина.
Белки этой группы связываются с мономерным актином и препятствуют его полимеризации. К ним относятся:
Профиллины - это сходные по свойствам, но различные по первичной структуре белки небольшого молекулярного веса (12,5 - 16 кД), широко распространенные в эукариотических клетках. Профиллины связываются с мономерным актином в соотношении 1:1. Во взаимодействии участвует С-концевой участок актина и С-конец профиллина. Образующийся при этом комплекс (профилактин) характеризуется резко уменьшенной способностью к полимеризации. На взаимодействие профиллина и актина влияет ряд факторов - изоформа актина, присутствие ионов магния, кальция, калия могут сильно менять прочность профилактинового комплекса. Профилактин может быть диссоциирован фосфолипидами. Это объясняется тем, что профиллин, кроме актина, способен реагировать также с фосфолипидами, а оба сайта связывания находятся в одном и том же С-концевом участке молекулы профиллина. Наиболее эффективно связывается с профиллином фосфатидилинозитол-4,5-бифосфат (PIP2) один из ключевых участников фосфатидилинозитольного пути передачи сигнала с поверхности клетки.
Фермент поджелудочной железы - ДНКаза I - образует очень прочный комплекс с G-актином. При этом теряется как активность ДНКазы, так и способность актина к полимеризации. ДНКаза I может также связываться с F-актином и индуцировать его деполимеризацию. При взаимодействии актина с ДНКазой I ингибируется не только способность актина к полимеризации , но и способность ДНКазы I гидролизовать ДНК. Это позволило разработать удобный метод определения количества мономерного актина в клетке. Кроме того, комплекс актина с ДНКазой I был успешно использован для кристаллизации и изучения трехмерной структуры актина. Однако физиологическая роль взаимодействия G-актина с ДНКазой I не ясна.
Тимозин бета-4. Это небольшой белок выделен из тромбоцитов. Как и профиллины, он связывается с G-актином и ингибирует его полимеризацию. Высокое содержание тимозина бета-4 обнаружено в тромбоцитах и макрофагах. Так же, как профилин и белок, связывающий витамин Д, тимозин бета-4 поддерживают уровень глобулярного актина, играя роль буфера. Предполагается также, что освобождение тимозина из комплекса с актином и появление его в плазме крови может быть сигналом, запускающим иммунную систему клетки
Белки, кэпирующие актиновые филаменты.
Белки этого типа названы так потому, что они присоединяются к одному из концов актинового филамента и блокируют как полимеризацию, так и деполимеризацию актина на этом конце. Большинство кэпирующих белков связывается с оперенным концом актинового филамента. Некоторые белки реагируют с острым его концом. К белкам, связывающимся с оперенным концом актинового филамента, относятся: гельзолин и его сывороточная форма - бревин, а также виллин, фрагмин и северин. Белками, кэпирующими острые концы актиновых филаментов, являются, например, акументин из макрофагов с молекулярной массой 65 кД и бета-актинин, выделенный из клеток мышц и почек.
Большинство из этих белков взаимодействует с «быстрым» концом нити. Их можно разделить на 3 группы: гельзолин/виллин, фрагмин/северин и белки, которые называются просто кэпирующими белками. Содержание кэпирующих белков в клетке примерно на два порядка ниже, чем содержание актина, т.е. ни нить актина приходится одна молекула кэпирующего белка. Большинство из кэпирующих белков взаимодействует с N-концевым сегментом актиновой нити (единственным известным исключение является С-концевая часть гельзолина). Некоторые из них содержат много основных аминокислотных остатков, что позволяет предложить пространственный механизм взаимодействия этих белков с актином.
Белки, взаимодействующие с "медленным" концом актиновой нити, изучены хуже. К ним относятся акументин и бета-актинин. Кроме того, способностью блокировать "медленный" конец обладает комплекс спектрина с белком 4.1 из эритроцитов. Существует также группа кэпирующих низкомолекулярных белков, которые связывают G-актин и режут нити. По-видимому, функцией этих белков является деполимеризация нитей актина в процессе перестройки актиновых структур в клетке.
Стабилизирующие белки.
Основными белками, стабилизирующими актиновые филаменты, являются тропомиозины. Это близкородственная группа белков, присутствующая в сократительном аппарате всех клеток. Она получила свое название благодаря тропомиозину мышц - первому известному члену этой группы. Тропомиозин мышц состоит из двух субъединиц по 33 кД (284 аминокислоты). Димер представляет собой палочковидную структуру, длиной около 40 нм.
Т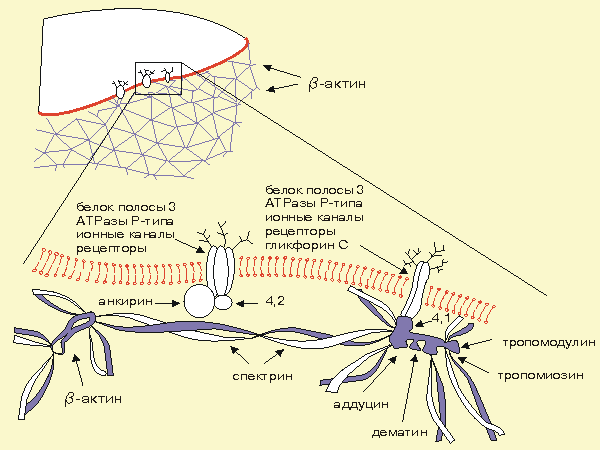 ропомиозин
взаимодействует с латеральной частью
актинового филамента. При этом молекулы
тропомиозина соединяются друг с другом
конец в конец, образуя две сплошные
продольные нити в бороздках актинового
филамента. Имеется множество изоформ
тропомиозина,
экспрессирующихся тканеспецифическим
образом. Они различаются по молекулярному
весу (от 30 до 40 кД) и изоэлектрической
точке. Все множество изоформ в высших
эукариотах образуется из, по крайней
мере, 4 генов.
Каждый из генов кодирует несколько
изоформ посредством альтернативных
промоторов
или альтернативного
сплайсинга.
Связывание тропомиозина с актиновыми
филаментами стабилизирует их, предотвращая
их спонтанную фрагментацию, но не
разрезание гельзолином.
Тропомиозин участвует во взаимодействии
актина
со спектрином,
обеспечивающее формирование двумерной
сети примембранного
цитоскелета,
как и другие белки, обладающие
спектринсвязывающей активностью:
аддуцин,
тропомодулин,
дематин.
ропомиозин
взаимодействует с латеральной частью
актинового филамента. При этом молекулы
тропомиозина соединяются друг с другом
конец в конец, образуя две сплошные
продольные нити в бороздках актинового
филамента. Имеется множество изоформ
тропомиозина,
экспрессирующихся тканеспецифическим
образом. Они различаются по молекулярному
весу (от 30 до 40 кД) и изоэлектрической
точке. Все множество изоформ в высших
эукариотах образуется из, по крайней
мере, 4 генов.
Каждый из генов кодирует несколько
изоформ посредством альтернативных
промоторов
или альтернативного
сплайсинга.
Связывание тропомиозина с актиновыми
филаментами стабилизирует их, предотвращая
их спонтанную фрагментацию, но не
разрезание гельзолином.
Тропомиозин участвует во взаимодействии
актина
со спектрином,
обеспечивающее формирование двумерной
сети примембранного
цитоскелета,
как и другие белки, обладающие
спектринсвязывающей активностью:
аддуцин,
тропомодулин,
дематин.
Белки, сшивающие актиновые филаменты.
Белки, образующие сшивки между филаментами актина, способствуют образованию разнообразных трехмерных суперструктур актина. Среди них можно выделить несколько групп.
