
- •12) Свойства аминокислот
- •Амфотерные свойства и изоэлектрическая точка белков
- •23) 1. Состав нуклеиновых кислот
- •24) 1.1. Состав днк
- •1.2. Состав рнк
- •Участвующие в трансляции
- •26) Биосинтез белка
- •Активный центр ферментов
- •34) Классификация белков (по форме, по сложности строения, по растворимости, по функциям)
- •Виды нуклеиновых кислот – днк и рнк, их биологическая роль, локализация в клетке, хим. Состав. Понятие о нуклеотидах и нуклеозидах.
- •30) Роль витаминов в обмене веществ. Классификация витаминов. Гипо-, авитаминозы. Связь между витаминами и ферментами. Общая характеристика жирорастворимых витиминов
- •Витамины группы к
- •32) Ферментативных реакций кинетика
- •35) Окисление биологическое
- •Роль глюкозы в организме человека
- •Регуляция уровня глюкозы (сахара) в крови.
- •Гликолиз
- •47) Азотистый баланс
Витамины группы к
Витамин K (нафтохинон). При авитаминозе K возникают самопроизвольные кровотечения (носовые кровотечения, внутренние кровоизлияния). Кроме этого, любые повреждения кровеносных сосудов при авитаминозе K могут привести к обильным кровотечениям. У человека авитаминоз K встречается реже, чем другие авитаминозы. Это объясняется тем, что смешанная пища содержит довольно много витамина K; кроме того, витамин K синтезируется клеточной микрофлорой кишечника в количестве, достаточном для предотвращения К-авитаминоза. Несколько по-иному обстоит дело у грудного ребенка. В первые дни жизни у него еще нет бактерий в кишечнике, поэтому витамин K должен поступать к нему с материнским молоком.
Биологическая рольВитамин K принимает участие в механизме свертывания крови. Он необходим для нормального образования в плазме крови белка протромбина, являющегося неактивным предшественником тромбина – фермента, превращающего белок плазмы крови фибриноген в фибрин – нерастворимый волокнистый белок, способствующий формированию сгустка крови. Чтобы протромбин мог активироваться и превратиться в тромбин, он должен связывать ионы Са2+. При недостатке витамина K в организме животных синтезируются дефектные молекулы протромбина, которые не могут связывать ионы Са2+.
ИсточникНаиболее богаты витамином K зеленые листья каштана, крапивы, люцерны, овощи – капуста, шпинат, тыква, зеленые томаты, растительное масло, ягоды рябины.Из животных продуктов он содержится только в печени свиньи. Суточная потребность в витамине K для человека не установлена, так как он синтезируется микрофлорой кишечника.
32) Ферментативных реакций кинетика
ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ КИНЕТИКА, изучает закономерности протекания во времени ферментативных р-ций, а также их механизм; раздел кинетики химической.
Каталитич. цикл конверсии в-ва S (субстрата) в продукт P под действием фермента E протекает с образованием промежут. соед. Xi:
![]()
где ki - константы скорости отдельных элементарных стадий, KS - константа равновесия образования фермент-субстратного комплекса X1 (ES, комплекс Михаэлиса).
При данной т-ре скорость р-ции зависит от концентраций фермента, субстрата и состава среды. Различают стационарную, предстационарную и релаксационную кинетику ферментативных р-ций.
Стационарная
кинетика. В
стационарном состоянии по промежуточным
соед. (dXi/dt
= 0, i = 1, ..., n) и при избытке субстрата
![]() ,
где [S]0
и [E]0
- начальные концентрации
соотв. субстрата
и фермента,
кинетика процесса характеризуется
постоянным, неизменным во времени
уровнем концентраций
промежут. соед., а выражение для скорости
процесса v0,
наз. начальной стационарной скоростью,
имеет вид (ур-ние
Михаэлиса- Ментен):
,
где [S]0
и [E]0
- начальные концентрации
соотв. субстрата
и фермента,
кинетика процесса характеризуется
постоянным, неизменным во времени
уровнем концентраций
промежут. соед., а выражение для скорости
процесса v0,
наз. начальной стационарной скоростью,
имеет вид (ур-ние
Михаэлиса- Ментен):
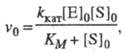 (1)
(1)
где значения kкат и Км - ф-ции констант скорости элементарных стадий и заданы ур-нениями:
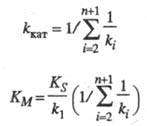
Величину
kкат
наз. эффективной каталитич. константой
скорости
процесса, параметр Км
- константой
Михаэлиса. Значение kкат
определяется величинами ki
наиб.
медленных стадий каталитич. р-ций и
иногда наз. числом оборотов фермента
(ферментной системы); kкат
характеризует число каталитич. циклов,
совершаемых ферментной системой в
единицу времени. Наиб. распространены
ферменты,
имеющие значение kкат.
для специфич. субстратов
в диапазоне 102-103
с-1.
Типичные значения константы
Михаэлиса лежат в интервале 10-3-
10-4
M.При больших концентрациях
субстрата,
когда![]()
![]() т.
е. скорость р-ции не зависит от концентрации
субстрата
и достигает постоянной величины, наз.
макс. скоростью. Графически ур-ние
Михаэлиса - Ментен представляет собой
гиперболу. Его можно линеаризовать,
используя метод двойных обратных величин
(метод Лайнуи-вера - Берка), т. е. строя
зависимость 1/v от 1/[S]0,
или др. методы. Линейная форма ур-ния
(1) имеет вид:
т.
е. скорость р-ции не зависит от концентрации
субстрата
и достигает постоянной величины, наз.
макс. скоростью. Графически ур-ние
Михаэлиса - Ментен представляет собой
гиперболу. Его можно линеаризовать,
используя метод двойных обратных величин
(метод Лайнуи-вера - Берка), т. е. строя
зависимость 1/v от 1/[S]0,
или др. методы. Линейная форма ур-ния
(1) имеет вид:
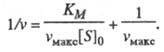 (2)
(2)
Она позволяет определить графически значения Км и vмакс (рис. 1).
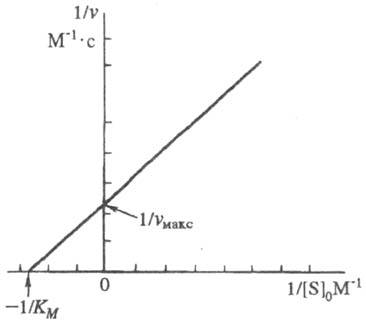
Рис. 1. График линейной трансформации ур-ния Михаэлиса - Ментен в двойных обратных величинах (по Лайнуиверу - Берку).
Величина
Км
численно равна концентрации
субстрата,
при к-рой скорость р-ции равна![]() , поэтому Км
часто служит мерой сродства субстрата
и фермента,
однако это справедливо лишь, если
, поэтому Км
часто служит мерой сродства субстрата
и фермента,
однако это справедливо лишь, если![]()
Величины Км и vm изменяются в зависимости от значений рН. Это связано со способностью участвующих в катализе групп молекулы фермента изменять свое состояние ионизации и, тем самым, свою каталитич. эффективность. В простейшем случае изменение рН приводит к протонированию или депротонированию, по крайней мере, двух ионизирующихся групп фермента, участвующих в катализе. Если при этом только одна форма фермент-субстратного комплекса (напр., ESH) из трех возможных (ES, ESH и ESH2) способна превращаться в продукт р-ции, то зависимость скорости от рН описывается ф-лой:
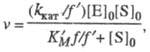
где f = 1 + [H+]/Kа + Kb /[H+] и f ' = 1 + [H+]/К'а + K'b/[H+] -т. наз. рН-ф-ции Михаэлиса, а Ка, Кb и К'a, K'b- константы ионизации групп а и b соотв. своб. фермента и фермент-субстратного комплекса. В координатах lg kкат - рН эта зависимость представлена на рис. 2, причем тангенсы углов наклона касательных к восходящей, независимой от рН, и нисходящей ветвям кривой должны быть равны соответственно +1, 0 и -1. Из такого графика можно определить значения рКа групп, участвующих в катализе.
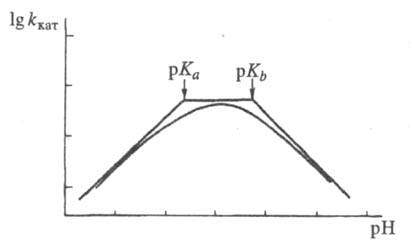
Рис. 2. Зависимость каталитич. константы от рН в логарифмич. координатах.
Скорость ферментативной р-ции не всегда подчиняется ур-нию (1). Один из часто встречающихся случаев - участие в р-ции аллостерич. ферментов (см. Регуляторы ферментов), для к-рых зависимость степени насыщения фермента от [S]0 имеет негиперболич. характер (рис. 3). Это явление обусловлено кооперативностью связывания субстрата, т.е. когда связывание субстрата на одном из участков макромолекулы фермента увеличивает (положит. кооперативность) или уменьшает (отрицат. кооперативность) сродство к субстрату др. участка.
Предстационарная
кинетика. При быстром
смешении
р-ров фермента
и субстрата
в интервале времен 10-6-10-1
с можно наблюдать переходные процессы,
предшествующие образованию устойчивого
стационарного состояния. В этом
предстационарном режиме при использовании
большого избытка субстрата
![]() система
дифференц. ур-ний, описывающая кинетику
процессов, линейна. Решение данного
типа системы линейных дифференц. ур-ний
дается суммой экспоненциальных членов.
Так, для кинетич. схемы, представленной
выше, кинетика накопления продукта
имеет вид:
система
дифференц. ур-ний, описывающая кинетику
процессов, линейна. Решение данного
типа системы линейных дифференц. ур-ний
дается суммой экспоненциальных членов.
Так, для кинетич. схемы, представленной
выше, кинетика накопления продукта
имеет вид:
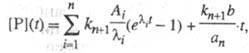
где
Ai-,
b, аn
- ф-ции элементарных констант
скорости;
![]() -корни
соответствующего характеристич. ур-ния.
-корни
соответствующего характеристич. ур-ния.
Величина,
обратная
![]() ,
наз. характеристич. временем процесса:
,
наз. характеристич. временем процесса:
![]()
Для р-ции, протекающей с участием n промежут. соед., можно получить n характеристич. времен.Исследование кинетики ферментативной р-ции в предстационарном режиме позволяет получить представление о детальном механизме каталитич. цикла и определить константы скорости элементарных стадий процесса.Экспериментально кинетику ферментативной р-ции в предстационарном режиме исследуют с помощью метода остановленной струи (см. Струевые кинетические методы), позволяющего смешивать компоненты р-ции в течение 1 мс.Релаксационная кинетика. При быстром возмущающем воздействии на систему (изменение т-ры, давления, электрич. поля) время, к-рое необходимо системе для достижения нового равновесия или стационарного состояния, зависит от скорости процессов, определяющих каталитич. ферментативный цикл.
Система ур-ний, описывающая кинетику процесса, линейна, если смещение от положения равновесия невелико. Решение системы приводит к зависимостям концентраций компонентов разл. стадий процесса в виде суммы экспоненциальных членов, показатели экспонент к-рых имеют характер времен релаксаций. Результатом исследования является спектр времен релаксации, соответствующий числу промежут. соед., участвующих в процессе. Величины времен релаксаций зависят от констант скорости элементарных стадий процессов.Релаксационные методы кинетики позволяют определить константы скорости отдельных элементарных стадий трансформации интермедиатов. Методы изучения релаксационной кинетики имеют разл. разрешающую способность: поглощение ультразвука - 10-6-10-10 с, температурный скачок - 1O-4-10-6 с, метод электрич. импульса - 10-4-10-6 с, скачок давления - 10-2 с. При исследовании кинетики ферментативных р-ций наиб, применение нашел метод температурного скачка.
Макрокинетика ферментативных процессов. Развитие методов получения гетерогенных катализаторов путем иммобилизации ферментов на разл. носителях (см. Иммобилизованные ферменты)обусловило необходимость анализа кинетики процессов с учетом массопереноса субстрата. Теоретически и экспериментально исследованы закономерности кинетики р-ций с учетом эффектов диффузионного слоя и для систем с внутридиффузионными затруднениями при распределении фермента внутри носителя.
В
условиях, когда на кинетику процесса
влияет диффузионный перенос субстрата,
каталитич. эффективность системы
уменьшается. Фактор эффективности
![]() равен
отношению плотности потока продукта в
условиях протекания ферментативной
р-ции с диффузионно пониженной
концентрацией
субстрата
к потоку, к-рый мог бы реализоваться в
отсутствие диффузионных ограничений.
В чисто диффузионной области, когда
скорость процесса определяется
массопереносом субстрата,
фактор эффективности для систем с
внешнедиффузи-онным торможением обратно
пропорционален диффузионному модулю
равен
отношению плотности потока продукта в
условиях протекания ферментативной
р-ции с диффузионно пониженной
концентрацией
субстрата
к потоку, к-рый мог бы реализоваться в
отсутствие диффузионных ограничений.
В чисто диффузионной области, когда
скорость процесса определяется
массопереносом субстрата,
фактор эффективности для систем с
внешнедиффузи-онным торможением обратно
пропорционален диффузионному модулю
![]() :
:
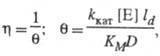
где ld - толщина диффузионного слоя, D - коэф. диффузии субстрата.
Для систем с внутридиффузионным торможением в р-циях первого порядка
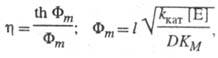
где Фт - безразмерный модуль (модуль Тиле).
При анализе кинетич. закономерностей в ферментативных реакторах широкое теоретич. и эксперим. развитие получили "идеальные" модели реакторов, проточный безградиентный реактор (проточный реактор идеального перемешивания), проточный реактор с идеальным вытеснением, мембранный реактор.
Кинетика полиферментных процессов. В организме (клетке) ферменты действуют не изолированно, а катализируют цепи трансформации молекул. Р-ции в полиферментных системах с кинетич. точки зрения можно рассматривать как последоват. процессы, специфич. особенностью к-рых является катализ ферментами каждой из стадий:
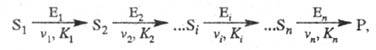
где vi, Ki - соотв. макс, скорость процесса и константа Михаэлиса i-й стадии р-ции соответственно.Важная особенность процесса - возможность образования устойчивого стационарного состояния. Условием-его возникновения может служить неравенство vi > v0, где v0 - скорость лимитирующей стадии, характеризуемой наименьшей константой скорости и тем самым определяющей скорость всего последоват. процесса. В стационарном состоянии концентрации метаболитов после лимитирующей стадии меньше константы Михаэлиса соответствующего фермента.Специфич. группу полиферментных систем составляют системы, осуществляющие окислит.-восстановит. р-ции с участием белковых переносчиков электронов. Переносчики образуют специфич. структуры, комплексы с детерминированной последовательностью переноса электрона. Кинетич. описание такого рода систем рассматривает в качестве независимой переменной состояния цепей с разл. степенью заселенности электронами.
Применение. Ферментативных реакций кинетику широко используют в исследовательской практике для изучения механизмов действия ферментов и ферментных систем. Практически значимая область науки о ферментах - инженерная энзимология, оперирует понятиями ферментативных реакций кинетики для оптимизации биотехнол. процессов.
33) Одним из относительно простых способов регуляции активности ферментов является регуляция с помощью изменения концентрации веществ, подвергающихся превращениям, то есть субстратов реакции: чем больше в распоряжении фермента имеется молекул веществ, превращения которых он осуществляет, тем выше (до определенных пределов) скорость процесса. При насыщении всех молекул фермента субстратом скорость реакции достигает максимального уровня. В дальнейшем скорость реакции может понизиться по мере исчерпания запасов субстрата и вновь возрасти при их восстановлении.Слишком большая концентрация субстрата также может понижать скорость ферментативной реакции. Этот феномен носит название субстратного торможения. В качестве примера субстратного торможения можно привести фермент, расщепляющий биологически активное вещество ацетилхолин - ацетилхолинэстеразу (АХЭ). К активному центру АХЭ субстрат (ацетилхолин) присоединяется двумя концами молекулы одновременно. При увеличении концентрации ацетилхолина с одной молекулой фермента могут одновременно реагировать две молекулы субстрата, но разными концами. В этом случае реакция, суть которой заключается в разрыве сложноэфирной связи в середине молекулы ацетилхолина (с образованием холина и уксусной кислоты), оказывается невозможной, и молекулы ацетилхолинэстеразы, нагруженные субстратом, оказываются тем не менее лишенными активности. Уменьшение концентрации ацетилхолина в среде приведет к диссоциации неактивного комплекса и снимет торможение. Этот механизм имеет важное физиологическое значение для регуляции концентрации ацетилхолина, который выполняет в нервной системе и мышцах роль медиатора, передающего возбуждение с одной клетки на другую.Регуляция ферментативной активности, осуществляемая в центре присоединения субстрата (этот центр называют активным центром фермента), носит название изостерической в отличие от аллостерической, осуществляющейся в дополнительном центре.Вещества, которые оказывают влияние на активность ферментов, называют эффекторами. Этомогут быть ингибиторы – соединения, тормозящие каталитический процесс, или активаторы – вещества, которые этот процесс ускоряют. Учение об ингибиторах ферментов имеет большое теоретическое и практическое значение для фармакологии и токсикологии. Многие лекарственные препараты являются ингибиторами ферментов. Например, ингибиторы амилаз успешно применяются для лечения заболеваний, связанных с повышенной активностью этих ферментов – диабета, ожирения, кариеса. Используемые в военном деле нервно-паралитические газы представляют собой специфические ингибиторы ферментов. В научных исследованиях специфические ингибиторы используются для изучения механизма действия ферментов, строения их активного центра. Например, многие из промежуточных продуктов гликолиза и дрожжевого брожения были открыты благодаря использованию ингибиторов, блокирующих последовательные стадии процесса. В результате такого блокирования соответствующие промежуточные продукты накапливались в количествах, достаточных для их выделения и идентификации. По типу действия ингибиторы можно разделить на обратимые и необратимые. Удаление обратимых ингибиторов из системы (диализом, гельфильтрацией и др.) восстанавливает каталитическую активность фермента. Обратимо действуют эффекторы: 1. Близкие аналоги субстрата, которые связываются активным центром фермента, но не подвергаются превращению. Занимая активный центр, они препятствуют связыванию истинного субстрата, конкурируя с ним, и поэтому называются конкурентными ингибиторами. 2. Кофакторы ферментов, без которых апофермент вообще не обладает активностью. Постепенное добавление их приводит к появлению активности, которая затем повышается до определенного предела, соответствующего полному насыщению. 3. Вещества, которые взаимодействуют с дополнительными, регуляторными центрами, несовпадающими с активным центром. Тем не менее, это взаимодействие изменяет конформацию в районе активного центра и влияет на кинетику ферментативного процесса. Такие соединения называются аллостерическими эффекторами. Они имеют важное биологическое значение, так как с их помощью осуществляется один из механизмов регуляции каталитической активности. Необратимую инактивацию вызывают соединения (найденные в живой природе или полученные путем синтеза), которые вступают в химическую реакцию с участком фермента, важным для проявления каталитической активности. Такие соединения, специфически реагирующие с определенными группами в молекулах ферментов (групп-специфические реагенты), используют для идентификации функциональных групп активного центра (метод химической модификации). С этой целью широко используются соединения, блокирующие SH-группы (иодацетамид, n-хлормеркурибензоат и др.), окисляющие остатки триптофана в кислой среде (N-бромсукцинимид), ацетилирующие остатки тирозина (N-ацетилимидазол), связывающие металлы (азид натрия) и т.д. Активаторы – вещества, которые повышают скорость ферментативных реакций, увеличивают активность ферментов. Они бывают органической и неорганической природы. Активаторы органической природы: желчные кислоты (активируют поджелудочную ли пазу), энтерокиназа (активирует трипсиноген), глутатион, цистеин, витамин С (повышают активность оскидоредуктаз). Активаторы неорганической природы: например, HCl активирует пепсиноген, ионы ме таллов (Na, Cl, K, Mg, Mn, Zn) активируют очень многие ферменты. Ионы металлов: а) спо собствуют образованию ферментсубстратного комплекса; б) служат донорами и акцептора ми электронов; в) принимают участие в образовании активного центра ферментов (Zn в со ставе карбангидразы, Fe – в составе цитохромов, каталазы, пероксидазы); г) выступают в ро ли аллостерических регуляторов. 2. Ингибиторы – вещества, которые уменьшают активность ферментов и замедляют хими ческие реакции. Различают обратимое и необратимое ингибирование: Если ингибитор связывается с молекулой фермента слабыми связями (Е+И ↔ ЕИ) то такой ингибитор легко удаляется и активность фермента восстанавливается; Если ингибитор связывается с молекулой фермента прочными ковалентными связями (Е+И→ ЕИ), то наступает необратимое подавление активности фермента
