
- •Оглавление
- •Предисловие
- •Методические указания
- •Глава 1. Этиология врожденных пороков сердца
- •Глава 3. Общие патофизиологические, патоморфологические и клинические признаки врожденных пороков сердца
- •Глава 4. Дефект межпредсердной перегородки
- •Глава 5. Дефект межжелудочковой перегородки
- •Глава 6. Открытый артериальный проток
- •Глава 7. Коарктация аорты
- •Глава 8. Изолированный стеноз легочной артерии
- •Глава 9. Аортальный стеноз
- •Глава 10. Пролапс митрального клапана
- •Глава 11. Аномалия Эбштейна
- •Глава 12. Тетрада Фалло
- •Глава 13. Аномалии расположения сердца
- •Глава 14. Врожденные пороки сердца и сосудов и беременность
- •Приложение №1. Анатомия сердца
- •Приложение №2. Схема кругов кровообращения
- •Контрольные вопросы
- •Тестовые задания
- •Ситуационные задачи
- •Заключение
- •Список литературы
Глава 3. Общие патофизиологические, патоморфологические и клинические признаки врожденных пороков сердца
Полиглобулия и полицитемия – характерная компенсаторная реакция организма в ответ на хроническую гипоксемию. В начальных стадиях ВПС снижение насыщения артериальной крови кислородом обусловлено сбросом венозной крови в артериальную. В поздних – артериальная гипоксемия обусловлена недостаточным насыщением крови кислородом в легочных капиллярах в результате склероза сосудов легких.
Увеличение объема циркулирующей крови и минутного объема крови, полицитемия и полиглобулия ведут к повышению вязкости крови, нарушению ее реологических свойств. В организме возникают условия для образования тромбов.
Нарушение газообмена и кровообращения ведут к сдвигу кислотно-щелочного равновесия. Накопление недооокисленных продуктов обмена и гипервентиляция обуславливают развитие метаболического ацидоза. Нарушение вентиляции и снижение парциального давления углекислого газа в артериальной крови приводит к дыхательному алкалозу.
Характерным следствием ВПС бледного типа является увеличение легочного кровотока, развитие гиперволемии малого круга и ЛГ. ЛГ обусловлена не только интенсификацией легочного кровотока, но и повышением сосудистого сопротивления легких. Обычно к повышению легочного сосудистого сопротивления приводят обструктивные, облитерирующие структурные изменения сосудов легких. Патологический характер изменений заключается в атеросклерозе ЛА, расширении ствола и крупных ветвей, фиброзе стенки мелких артерий. При длительно существующей гиперволемии и легочной гипертензии возможно возникновение мелких очагов ателектаза и эмфиземы легких.
Для ВПС характерны выраженные изменения миокарда. Патологические сдвиги биохимических, обменных и энергетических процессов в сердечной мышце ведут к развитию кардиомиопатии. В зависимости от характера и выраженности нарушений гемодинамики преобладает дилатация или гипертрофия миокарда. У ряда бльных возникает кардиосклероз, наиболее выраженный в тех отделах сердца, которые находились в состоянии компенсаторной гиперфункции и затем гипертрофии
Почти любой порок, встречающийся у взрослых может давать симптоматику уже в детстве в виде ограничения подвижности в результате быстрой утомляемости, слабости, частых ОРЗ и пневмоний, отставания в физическом развитии.
Примерно у 7% больных патология сердца сочетается с большими пороками развития: расщеплением губы, неба, полидактилией, инверсией внутренних органов. У 40% пациентов ВПС сочетаются с малыми аномалиями развития: лицевой дисморфизм, микрофтальмия, гипоплазия верхней или нижней челюсти, готическое небо, глухота и др.
Наличие симптомов хронической сердечной недостаточности
Сердечные шумы при ВПС выслушиваются не в «классических» точках и имеют характерную динамику в процессе течения пороков.
Глава 4. Дефект межпредсердной перегородки
Дефект межпредсердной перегородки (ДМПП) — ВПС с наличием сообщения между предсердиями, являющияся результатом ненормального развития первичных или вторичных межпредсердных перегородок и эндокардиальных валиков.
Это распространенный ВПС, встречается в 7,8% случаев всех ВПС, выявляемых в грудном возрасте, и у 30% — у взрослых, в 2-3 раза чаще у женщин.
В зависимости от расположения дефекта и эмбриологических особенностей развития перегородки различают:
Высокий вторичный ДМПП - встречается в 15% случаев и локализуются около устья верхней полой вены (ВПВ) и синусового узла, нередко сочетается с синдромом слабости синусового узла, АВ-узловым ритмом и аномальным дренажём лёгочных вен (рис. 1).
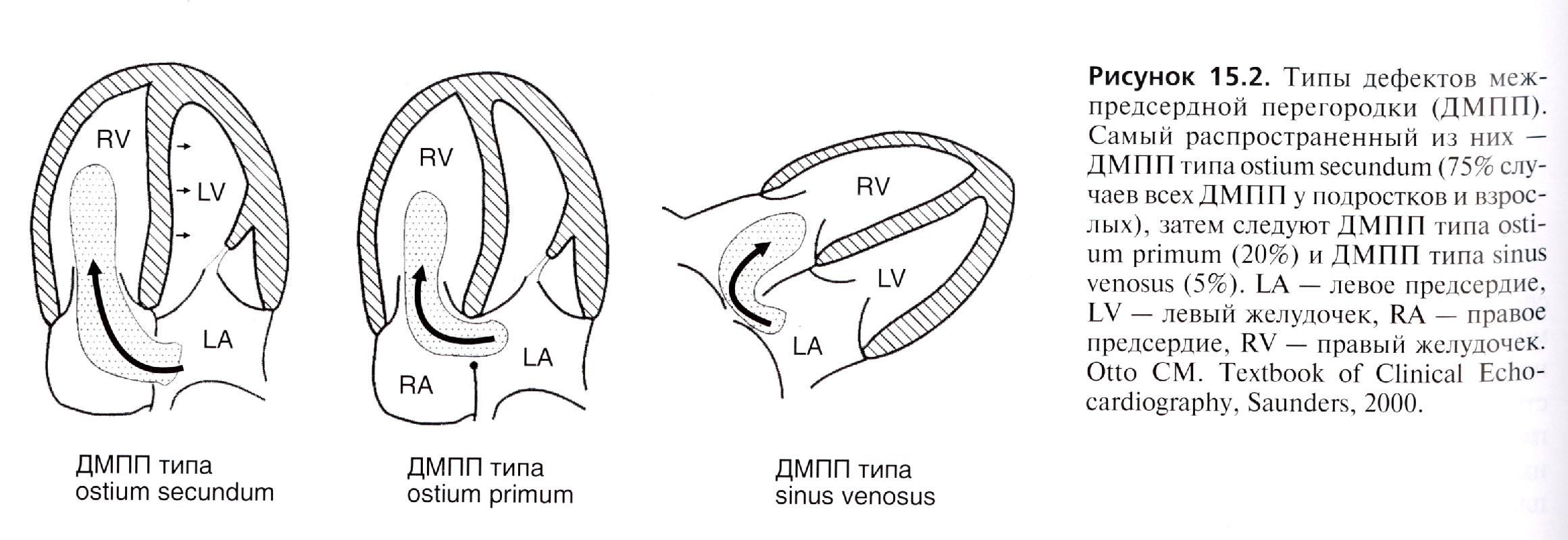
Рис. 1. Типы ДМПП.
Центральный вторичный ДМПП - самый частый - 66-70% всех случаев ДМПП. Дефекты при этом локализуются в области овальной ямки, часто бывают множественными, сопутствуют многим синдромам: синдрому Холт–Орама (ДМПП в сочетании с гипоплазией пальцев), синдрому Лютембаше (сочетание ДМПП со стенозом митрального клапана), сочетанию ДМПП с пролапсом митрального клапана и др.
Низкий вторичный ДМПП встречается в 1% случаев и располагается в области устья нижней полой вены (НПВ).
Первичный ДМПП образуется в месте формирования эндокардиальных валиков в результате незаращения первичного сообщения между предсердиями и располагается в нижней части межпредсердной перегородки, непосредственно над атриовентрикулярными клапанами и нередко сочетается с расщеплением передней створки митрального клапана, митральной недостаточностью и синдромом Дауна
Н арушения
гемодинамики
при вторичном ДМПП обусловлены сбросом
крови слева направо на уровне предсердий
(рис. 2).
арушения
гемодинамики
при вторичном ДМПП обусловлены сбросом
крови слева направо на уровне предсердий
(рис. 2).
Рис.
2. Схема и нарушения гемодинамики при
ДМПП. 1-ЛА;
2-аорта; 3- ЛЖ; 4- ПЖ; 5-ДП; 6- ПП; 7-ВПВ; 8- НПВ.
Объем сброса крови определяется не столько разностью давления в предсердиях (она небольшая – 5-6 мм. рт. ст.) (рис. 3), сколько относительной растяжимостью обоих желудочков.
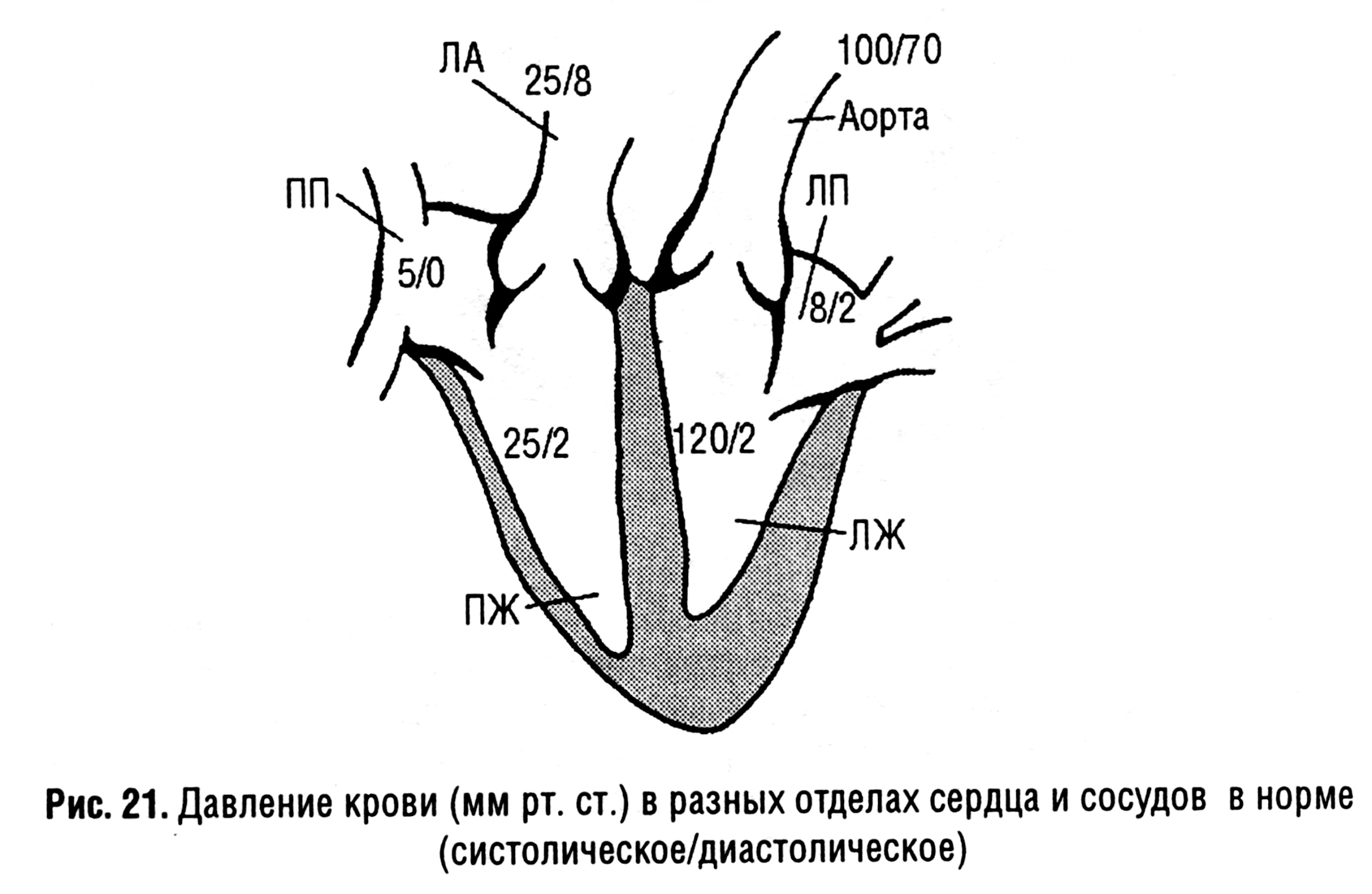
Рис. 3. Давление крови (мм.рт.ст.) в разных отделах сердца и сосудов в норме (систолическое/диастолическое)
Так как правый желудочек (ПЖ) более податлив и способность его к диастолическому расслаблению выше, чем левого желудочка (ЛЖ), сброс происходит из левого предсердия (ЛП) в правое предсердие (ПП). Поэтому основная нагрузка приходится на правые отделы. Увеличение кровотока через трехстворчатый клапан и клапан ЛА приводит к диастолической перегрузке и дилатации ПЖ. Значительная растяжимость правых отделов сердца, резервная емкость легочных сосудов способствуют тому, что ЛГ при ДМПП длительное время отсутствует и развивается только при возникновении склероза сосудов малого круга. При развитии склеротической стадии ЛГ диастолическая перегрузка ПЖ дополняется систолической, возникает гипертрофия ПЖ, конечно-диастолическое давление в ПЖ и давление в ПП повышаются, что ведет к уменьшению и смене направления сброса на уровне предсердий.
Клиника. При небольшом вторичном ДМПП течение часто длительно (до 15-20 лет) бессимптомное. В большинстве случаев к 30 годам общее состояние таких больных остается вполне удовлетворительным, хотя у них нередко возникают одышка, сердцебиение, быстрая утомляемость при физической нагрузке, частые инфекции органов дыхания. После 30 лет, как правило, наблюдаются наджелудочковые аритмии, фибрилляция предсердий, признаки ЛГ и сердечной недостаточности по правожелудочковому типу, значительно возрастает риск ТЭЛА и эмболии большого круга (парадоксальной). При больших размерах ДМПП возможно возникновение артериальной гипертонии за счет увеличения общепериферического сосудистого сопротивления.
При объективном осмотре можно выявить расширение границ сердца преимущественно вправо, сердечный горб, при смене шунта – диффузный цианоз, «барабанные палочки» и «часовые стекла». В течении порока принято выделять 2 условные гемодинамические стадии. В I стадию (до ЛГ) над легочной артерией во II м/р слева выслушивается мягкий систолический шум, возникающий в результате функционального стеноза легочной артерии (так как кровоток через клапан легочной артерии увеличен). II тон во II м/р слева расщеплен из удлинения времени выброса крови из ПЖ. Из-за увеличенного кровотока через трехстворчатый клапан может возникать фукциональный стеноз и выслушиваться диастолический шум на мечевидно отростке. Во II стадию порока (стадия ЛГ) появляется акцент II тона во II м/р слева как результат ЛГ. Там же может выслушиваться диастолический шум недостаточности клапана легочной артерии (шум Грехэма-Стилла). На мечевидном отростке можно выслушать систолический шум относительной недостаточности трехстворчатого клапана.
Инструментальная диагностика. ЭКГ у пациентов с ДМПП позволяет выявить признаки гипертрофии и перегрузки ПЖ (рис.4).

Рис. 4. ЭКГ при вторичном ДМПП
У 65% больных выявляют блокаду правой ножки пучка Гиса. В первые три декады жизни обычно определяют нормальный синусовый ритм, позже диагностируют фибрилляции предсердий и наджелудочковые тахикардии.
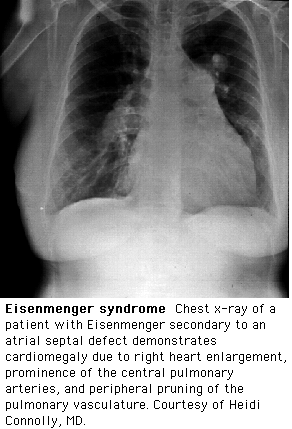
Рентгенологическое исследование органов грудной клетки выявляет: усиление лёгочного рисунка (за счёт переполнения артериального русла) и выбухание ствола лёгочной артерии (рис.5), расширение и неструктурность корней лёгких, выбухание дуги правого предсердия и смещение вверх правого кардиовазального угла. Тень сердца увеличена вследствие гипертрофии ПП и ПЖ. При рентгеноскопии — усиленная пульсация корней лёгких.
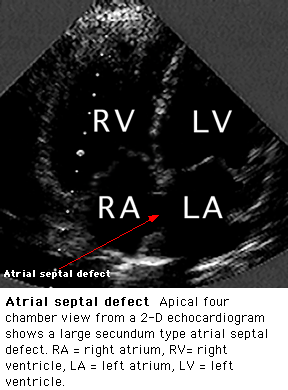
ДЭХОКГ позволяет обнаружить увеличение ПП и ПЖ, визуализировать ДМПП в допплеровском и В-режиме (рис. 6), оценить степень регургитации на трикуспидальном клапане и клапане легочной артерии, диагностировать сопутствующие аномалии (аномальный дренаж лёгочных вен, клапанные пороки и др.), определить степень сброса и отношение лёгочного минутного кровотока к системному (Qp/Qs).
Р
Рис. 6. ДЭХОКГ при вторичном ДМПП
грудной клетки при вторичном
ДМПП
Катетеризация сердца проводят взрослым пациентам с высокой лёгочной гипертензией для определения степени гемодинамических нарушений, а также для исключения сопутствующих пороков. Зондирование полостей сердца так же показано при подозрении на лёгочную гипертензию, перед операцией на открытом сердце и при противоречивых клинических данных. Вычисляют отношение лёгочного минутного кровотока к системному (Qp/Qs) — эталонный показатель величины сброса.
Правая атриография, ангиопульмонография: поступление контраста из правого предсердия в левое; выявление сопутствующего аномального дренажа лёгочных вен. При внутривенном контрастировании правых отделов сердца — эффект отрицательного контрастирования (вытеснение контрастного вещества струёй крови из левого предсердия).
Радионуклидная ангиокардиография (по методу первого прохождения или равновесная): регистрация патологического сброса и его количественная оценка, диагностика сопутствующего аномального дренажа лёгочных вен и нарушений функций желудочков.
Показания к оперативному лечению. У взрослых определяющими факторами в решении вопроса о хирургической коррекции порока служит тяжесть его состояния, состояние миокарда и легочных сосудов. Показанием к оперативному лечению при ДМПП является наличие гемодинамически значимого сброса крови слева направо (соотношение лёгочного и системного кровотока составляет 1,5:1 и более), даже в отсутствии симптомов.
Противопоказанием к хирургическому вмешательству может служить высокая лёгочная гипертензия со сбросом крови справа налево, обусловленная склеротическими изменениями лёгочных сосудов, отношение общего лёгочного сосудистого сопротивления к ОПСС 0,9 и более.
Методы оперативного лечения. Эндоваскулярная коррекция пуговичным или двухзаплатным устройством Сидериса либо устройством Амплатц (рис.7) выполнимо при центральных дефектах размером не более 2 см. При отсутствии опыта эндоваскулярного лечения небольшие дефекты ушивают в условиях искусственного кровообращения.
Рис. 7. Эндоваскулярное закрытие овального
окна окклюзером Амплатца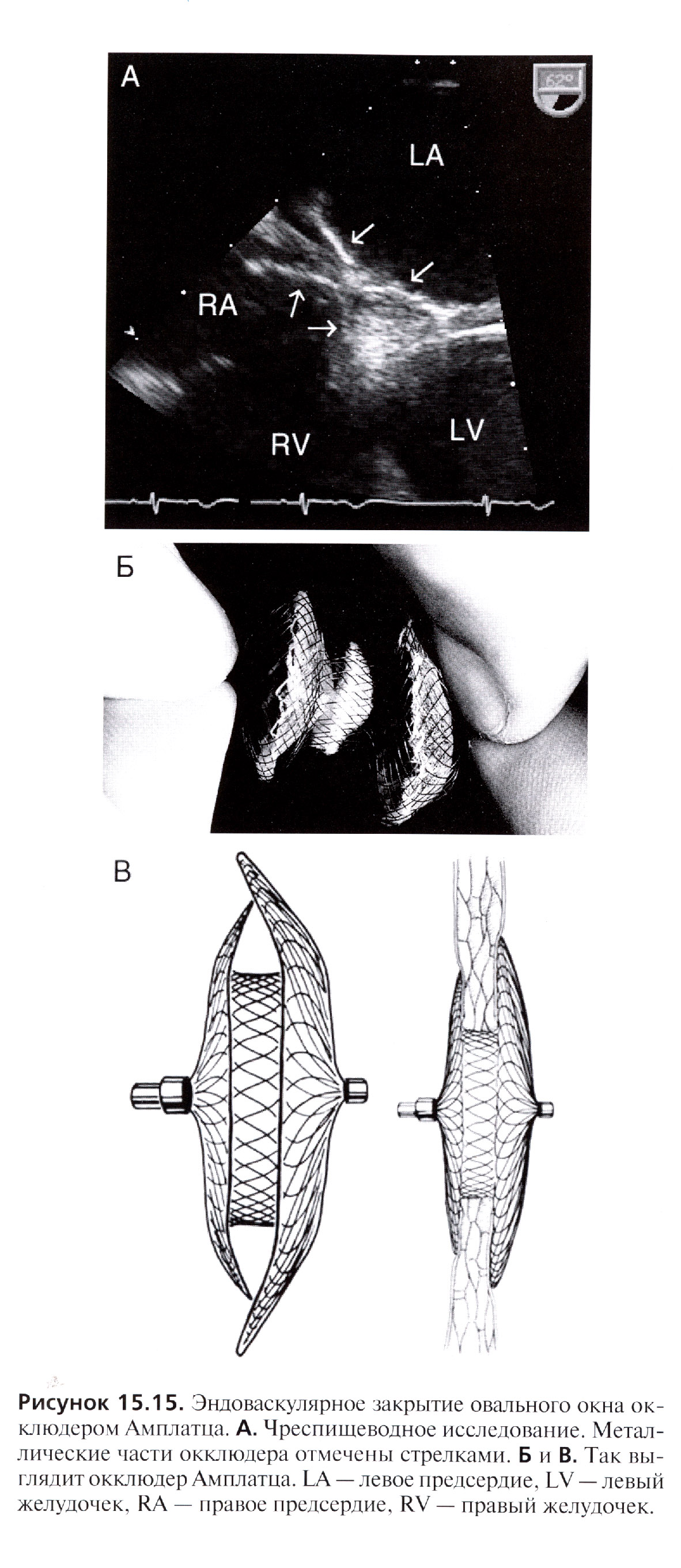
В остальных случаях рекомендуют пластику ДМПП синтетической или аутоперикардиальной заплатой в условиях искусственного кровообращения. При первичном ДМПП или частичной форме открытого АВ-канала пластику дополняют коррекцией недостаточности митрального клапана. В большинстве случаев, коррекцию осуществляют путём ушивания расщеплённой передней створки митрального клапана. Реже прибегают к протезированию клапана. В неосложнённых ситуациях проведение операции позволяет достичь хороших результатов. Послеоперационные осложнения включают: синдром слабости синусового узла (при высоком вторичном ДМПП), полную АВ-блокаду (после коррекции первичного ДМПП). При митральной недостаточности, существовавшей до операции, возможно усугубление симптомов после коррекции ДМПП, так как сброс в ПП блокируется, а митральная неостаточность остается. Фибрилляция предсердий, возникшая до операции, как правило, сохраняется и после неё.
Медикаментозная терапия должна включать быстрое подавление инфекции дыхательных путей, антиритмические препараты при появлении фибрилляции предсердий или суправентрикулярной тахикардии и мероприятия, рекомендуемые при сердечной недостаточност. Несмотря на то, что риск инфекционного эндокардита у этих больных невысок, перед стоматологическими вмешательствами целесообразен профилактический прием антибиотиков. При первичном ДМПП, больших дефектах вторичного ДМПП и сочетании ДМПП с пороками митрального клапана назначают антибиотики до и в течение 6 месяцев после неосложнённой хирургической коррекции.
Прогноз. Изолированный вторичный ДМПП имеет благоприятное течение в первые 2-3 декады жизни. Средняя продолжительность жизни без лечения составляет 36-40 лет, имеются наблюдения забольными, прожившими 70 лет и более, но большинство из них становятся тяжелыми инвалидами в возрасте старше 50 лет, в результате возникшей выраженной ЛГ, правожелудочковой сердечной недостаточности и фибрилляции предсердий. Причиной смерти больных с ДМПП (без операции) является правожелудочковая сердечная недостаточность, реже тромбоз ЛА, эмболии сосудов головного мозга. 5–15% больных умирают до 30 лет. 10-летняя выживаемость — 90%, 20-летняя — 88%, 30-летняя — 67%; 40-летняя — 44%, 50-летняя — 25%, 60-летняя — 13%, 70-летняя — 7%.
