
Медь и ее соединения
Медь – металл красно-желтого цвета. Он относительно мягок, очень пластичен и обладает высокой теплопроводностью и электрической проводимостью, уступая по этим показателям только серебру; обладает наименьшей активностью среди рассмотренных выше 3d-металлов, которые вытесняют медь из растворов ее солей, например: CuSO4 + Fe = FeSO4 + Cu
Медь не реагирует с соляной и разбавленной серной кислотами, но растворяется в концентрированной серной кислоте, а также в азотной кислоте любой степени окисления:
Cu + 2H2SO4(конц) = CuSO4 + SO2 + 2H2O
Cu + 4HNO3(конц) = Cu(NO3)2 + 2NO2 + 2H2O
3Cu + 8HNO3(разб) = 3Cu(NO3)2 + 2NO + 4H2O
При действии щелочей на соли меди (II) выпадает голубой осадок гидроксида:
CuSO4 + 2KOH = K2SO4 + Cu(OH)2
который уже в горячем растворе разлагается, образуя черный оксид меди (II):
Cu(OH)2 = CuO + H2O
Растворением оксида или гидроксида меди в кислотах получают соединения меди (II), растворы которых окрашены в голубой цвет благодаря наличию в них иона [Cu(H2O)6]2+.
При растворении гидроксида меди (II) в концентрированных щелочах образуются тетрагидроксокупраты (II): 2KOH + Cu(OH)2 = K2[Cu(OH)4], из чего следует, что гидроксид меди (II) обладает амфотерными свойствами.
Водный раствор аммиака также растворяет Сu(ОН)2 за счет образования ярко-синего комплекса: Сu(ОН)2 + 4NH3 = [Сu(NH3)4](OH)2.
Соединения меди (I). Помимо соединений со степенью окисления +2 для меди известны соединения со степенью окисления +1. Соли меди (I), как правило, нерастворимы в воде (CuQ, CuI, Cu2S), но зато очень хорошо растворимы в концентрированном растворе аммиака с образованием комплексных солей; также хорошо растворяется в аммиаке оксид меди (I):
CuCl2 + 2NH3 = [Сu(NH3)2]С1
C2O + 4NH3 + Н2O = 2 [Сu(NH3)2]OH
Соединения меди (I) имеют белую окраску либо бесцветны. Это объясняется тем, что в ионе меди(I) все пять 3d-орбиталей заполнены парами электронов. Исключением является оксид Сu2О, который имеет красновато-коричневую (оранжевую) окраску.
Изменение окраски соединений меди при переходе из степени окисления +2 в степень окисления +1 используется в органической химии для качественного анализа. Так, свежеосажденный Сu(ОН)2 голубого цвета восстанавливается альдегидами или углеводами (глюкозой) в желтый осадок гидроксида меди (I) (на самом деле гидроксид меди (I) как индивидуальное соединение не получен; в растворе образуется гидратированный оксид Cu2O xH2O, а из раствора может быть выделен только С2О (см.: Химическая энциклопедия. М.: Советская энциклопедия, 1990. Т. 2. С. 1329.); последний даже при слабом нагревании распадается на воду и оранжевый оксид Сu2O:
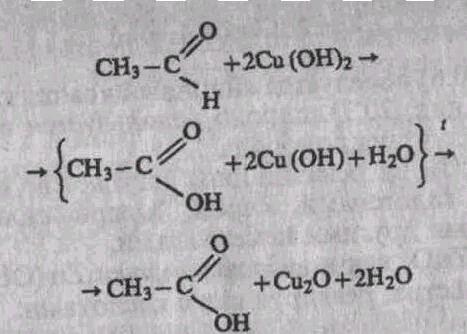
Заметим, также, что комплексные соли меди (I) широко используются в органической химии для обнаружения, а иногда и для выделения алкинов из смесей их с другими углеводородами (речь идет об алкинах с тройной связью на конце цепи):
![]()
В лабораторных условиях медь получают восстановлением CuO водородом или вытеснением железом или цинком из водного раствора CuSO4. Промышленное получение меди основано на обработке сульфидных руд меди. Медь в чистом виде используется для изготовления кабеля, проводоки и труб. Большая часть меди используется в виде сплавов, основная часть которых латуни (медно-цинковые сплавы, содержащие от 4 до 50 % цинка) и бронзы. Бронзы – сплавы на основе меди, в которых главным легирующим элементом может быть любой химический элемент, за исключением цинка и никеля. Наиболее известны оловянные и алюминиевые бронзы. Оловяная бронза – древнейший сплав, выплавленный человеком.
