
Марганец и его соединения
Марганец – твердый металл серого цвета. В соединениях марганец проявляет степени окисления +2, +4, +6 и +7. Чем выше степень окисления, тем более ковалентны соответствующие соединения, тем выше кислотность его оксидов.
Марганец в мелкораздробленном состоянии окисляется галогенами, кислородом, серой, образуя производные со степенью окисления +2; легко растворяется в разбавленных кислотах «не окислителях», при этом всегда образуется соль со степенью окисления марганца +2:
Mn + H2SO4 = MnSO4 + H2
Mn + 2HCl = MnCl2 + H2
Степень окисления +2 наиболее характерна не только для солей марганца, ей отвечают также оксид МnО и гидроксид Мn(ОН)2, обладающие типичными основными свойствами.
Оксид
марганца
(II) МnО
при нагревании может быть окислен даже
кислородом воздуха до оксида марганца
(IV): ![]()
Оксид марганца (IV) – нерастворимое в воде соединение коричнево-черного цвета, одно из наиболее важных соединений марганца (IV).
Оксид марганца (IV) обладает окислительными свойствами:
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
однако и сам может быть окислен с образованием соединений шестивалентного марганца (манганатов), например при сплавлении его с нитратом калия и щелочью:
MnO2 + KNO3 + 2KOH = K2MnO4 + KNO2 + H2O
Соединения марганца (VI) – манганаты – устойчивы только в щелочной среде. Они имеют темно-зеленую окраску. Их окисление хлором приводит к образованию перманганатов – производных марганца (VII), фиолетово-малинового цвета: 2K2MnO4 + Cl2 = 2KmnO4 + 2KCl
Соответствующие степеням окисления +6 и +7 оксиды МnО3 и Мn2O7 обладают только кислотными свойствами. Для последнего известна очень сильная марганцовая кислота НМnO4.
Перманганаты – сильнейшие окислители. Обычно в лабораториях используют малорастворимый, а потому легко получаемый перманганат калия. В зависимости от рН среды перманганаты восстанавливаются до различных степеней окисления.
В щелочной среде образуются манганаты:
Na2SO4 + 2KMnO4+ 2KOH = 2Na2SO4 + 2K2MnO4 + H2O
В нейтральной – диоксид марганца:
3C2H4 + 2KMnO4 + 4H2O = 3C2H4(OH)2 + 2MnO2 + 2KOH
В кислой среде, как правило, – соли марганца (II):
2KMnO4 + 5KNO2 + 3H2SO4 = 2MnSO4 + 5KNO3 + K2SO4 + 3Н2О
Марганец получают действием кремния на диоксид марганца при нагревании:
MnO2 + Si = Mn + SiO2
Большую часть его используют в качестве легирующих добавок к стали, которой он придает твердость и коррозионную стойкость.
Триада железа
Располагающиеся по соседству в таблице Менделеева и относящиеся к восьмой группе железо, кобальт и никель образуют триаду железа. Все три элемента – серебристо-белые металлы, прочные в чистом виде ковкие, обладающие хорошей теплопроводностью и электрической проводимостью и проявляющие ферромагнетизм. Они обладают электронными конфигурациями 3d64s2, 3d74s2 и 3d84s2 и все проявляют степень окисления +2. Железо проявляет и степень окисления +3, поскольку при этом образуется наполовину заполненный 3d-уровень (Fe3+: 3d54s0).
Железо,
кобальт и никель химически активны и
взаимодействуют с галогенами, серой и
кислородом, образуя соединения со
степенью окисления +2, за исключением
фторида, хлорида и оксида железа, где
проявляется степень окисления +3. Реагируя
с водяным паром, железо образует смешанный
оксид железа (II, Ш)FеО
Fе2O3
(Fе3O4): 3Fe
+ 4H2O
![]() Fe3O4
+ 4H2
Fe3O4
+ 4H2
В природе оксид Fe3O4 встречается в виде минерала магнетита (проявляет ферромагнитные свойства).
На воздухе в присутствии влаги железо ржавеет: 4Fe + 3О2 + 6Н2О = 4Fe(ОН)3
Все три металла пассивируются концентрированными серной и азотной кислотами на холоду, но при нагревании растворяются в них очень легко, причем железо всегда образует соли со степенью окисления +3, а кобальт и никель – со степенью окисления +2:
2Fe + 6Н2SO4(конц) = Fe2(SO4)3 + 3SO2 + 6Н2О
Ni + 2Н2SO4(конц) = NiSO4 + SO2 + 2Н2О
Co +4НNO3(конц) = Co(NO3)2 + 2NO2 + 2Н2О
Разбавленная серная кислота, а также галогеноводородные и другие кислоты – «не окислители» переводят металлы в соли со степенью окисления +2:
Fe + Н2SO4 = FeSO4 + H2
Co + 2HBr = CoBr2 + H2
При действии щелочи на соли двухвалентных металлов выпадают в осадки соответствующие гидроксиды: белый Fe(ОН)2, розовый Со(ОН)2 и светло-зеленый Ni(ОН)2. Гидроксид железа (II) быстро окисляется на влажном воздухе, давая бурый гидроксид железа (III):
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
В отличие от Fe(OH)2 гидроксиды двухвалентного никеля и кобальта не окисляются кислородом воздуха. Точно так же соли железа (II) легко окисляются в водных растворах:
6FeSO4 + 3Cl2 = 2FeCl3 + 2Fe2(SO4)3
тогда как соответствующие производные кобальта и никеля к окислению достаточно устойчивы.
При действии на соли железа (III) растворами щелочей выпадает осадок гидроксида железа (III): FeCl3 + 3KOH = Fe(OH)3 +KCl
который в отличие от Fе(ОН)2 амфотерен: при нагревании он способен растворяться в щелочах с образованием тетрагидроксиферрита (III): Fe(ОН)3 +КОН =К[Fe(ОН)4]
При разложении гидроксида железа (III) образуется оксид железа (III): 2Fe(OH)3 = Fe2O3 + 3H2O, который также амфотерен и способен реагировать как с кислотами:
Fe2O3 + 6HCl = 2FeCl3 + 3H2O
так и с расплавами щелочей: Fe2O3 + 2NaOH = 2NaFeO2 + H2O, образуя соли железистой кислоты HFeO2 – ферриты.
По своему отношению к кислотам и щелочам соединения железа (III) напоминают соответствующие производные алюминия и хрома.
Окисление солей железа (III) хлором в щелочной среде приводит к образованию ферратов – соединений железа (VI): 2K[Fe(OH)4] + 3Cl2 +8KOH = 2K2FeO4 + 6KCl + 8H2O
Эти соединения красного цвета – сильнейшие окислители, например, в щелочной среде окисляют водный аммиак: 2K2FeO4 + 2NH3 + 2H2O = N2 + 2KOH + 2K[Fe(OH)4]
Комплексные соединения. Для железа (равно как и для никеля с кобальтом) известны также многочисленные соединения, в которых оно входит в состав анионов. Отметим еще две важные комплексные соли железа: гексацианоферрат (II) калия К4[Fe(CN)6] (желтая кровяная соль) и гексацианоферрат (III) калия K3[Fe(CN)6] (красная кровяная соль), являющиеся реактивами для качественного определения ионов Fe3+ и Fe2+ соответственно. (Катионы Fe3+ могут быть обнаружены также с помощью бесцветного раствора тиоцианата (роданид) аммония NH4NCS, который с соответствующими солями образует роданид железа кроваво-красного цвета:
Fe(NO3)3 + 3NH4NCS = Fe(NCS)3 + 3NH4NO3
Добавление раствора гексацианоферрата (II) к растворам, в которых содержатся ионы железа (III), вызывает образование темно-синего осадка, часто называемого берлинской лазурью:
4K4[Fe(CN)6] + 4Fe3+ = 4KFeIII[FeII(CN)6] + 12K+
Такой же темно-синий осадок образуется при добавлении раствора гексацианоферрата (III) к растворам, содержащим ионы железа (II). В этом случае осадок называется турнбуллевой синью:
3K3[Fe(CN)6] + 3Fe3+ = 3KFeII[FeIII(CN)6] + 6K+
Установлено, что берлинская лазурь и турнбуллева синь – это одно и то же вещество, так как комплексы, образующиеся в реакциях, находятся между собой в равновесии:
KFeIII[FeII(CN)6] KFeII[FeIII(CN)6]
Особым типом комплексных соединений являются карбонилы переходных металлов. Железо, кобальт и никель реагируют с угарным газом под давлением, образуя Fe(CO)5, Co(CO)4 и Ni(CO)4. Карбонилы интересны тем, что металлы проявляют в них нулевую степень окисления. Обсудим образование карбонила на примере карбонила железа: Fe + 5CO = Fe(CO)5
В свободном металле железо обладает электронной конфигурацией 3d64s2 (см. табл. 1). В возбужденном состоянии железо может приобретать энергетически выгодную электронную конфигурацию 3d54s14p2 (т. е. имея наполовину заполненную d-орбиталь). Молекулы СО, являющиеся донорами электронной пары, взаимодействуют с вакантными 3d-орбиталями, образуя при этом ковалентные связи Fe-C по донорно-акцепторному механизму, причем электронная плотность смещается от атома углерода к атому железа:
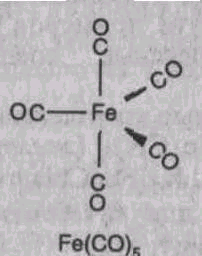
Частичное увеличение отрицательного заряда на атоме металла компенсируется участием его d-электронов в связи, поэтому степень окисления металла равна 0.
При нагревании карбонилы металлов разлагаются на металл и оксид углерода (II), что используется для получения металлов особой чистоты.
