
- •1.Будова атомів металів. Положення металів у періодичній системі. Групи металів
- •Фізичні властивості металів
- •2.Загальна характеристика елементів-неметалів
- •Хімічні властивості металів
- •Способи одержання металів
- •Неметали як прості речовини
- •Хімічні властивості неметалів
- •3. Вуглеводи і їхні властивості.
- •Класифікація і розповсюдження
- •Фізико-хімічні властивості.
- •Біологічна роль.
- •4.Оксигеновмісні органічні сполуки
4.Оксигеновмісні органічні сполуки
Спирти — це органічні сполуки, до складу яких входить одна або декілька гідроксильних груп (гідроксигруп), сполучених з вуглеводневим радикалом.
Гідроксигрупа називається функціональною групою, оскільки вона зумовлює основні хімічні властивості спиртів.
У насичених одноатомних спиртів усі карбонові зв’язки ординарні і лише один атом Гідрогену заміщений гідроксигрупою. Назви спиртів утворюються від назв відповідних вуглеводнів з додаванням суфікса -ол (наприклад етанол). Існують також тривіальні назви (наприклад етиловий спирт).
Багатоатомними називаються спирти, у молекулах яких два або більше атомів Гідрогену заміщені на гідроксигрупи.
Якщо в молекулі спирту містяться три гідроксигрупи, він належить до триатомних спиртів. У назві такого багатоатомного спирту присутній суфікс -тріол.
Феноли — це органічні сполуки, у молекулах яких гідроксильні групи зв’язані з бензеновим ядром.
Феноли
з однією гідроксигрупою називаються
одноатомними. Найпростіший фенол має
загальну формулу
![]() . Його структурна формула:
. Його структурна формула:
![]() або
або
![]()
Радикал
![]() називається феніл.
називається феніл.
Альдегідами називаються органічні сполуки, у молекулах яких міститься альдегідна функціональна група: –
Назви альдегідів за міжнародною номенклатурою утворюються від назв відповідних вуглеводнів із додаванням суфікса -аль. Тривіальні назви утворюються від назв кислот, які можуть бути одержані з цих альдегідів.
Загальна
формула альдегідів:
![]()
Карбонові кислоти — це органічні сполуки, до складу молекул яких входить карбоксильна функціональна група:
–![]()
Насичені одноосновні карбонові кислоти містять одну карбоксильну групу й ординарні карбон-карбонові зв’язки.
У результаті взаємного впливу атомів у карбоксильній групі:
— зв’язок С=О міцніший, ніж в альдегідній групі;
— зв’язок O–H менш міцний, ніж у спиртах;
— атом Гідрогену більш рухливий і реакційноздатний.
Міжнародні систематичні назви карбонових кислот утворюються від назв відповідних вуглеводнів із додаванням закінчення -ова і слова кислота. Наприклад, метанова кислота.
Загальна
формула насичених одноосновних карбонових
кислот
![]() або
або
![]() .
.
Естери можна розглядати як похідні кислот, у яких Гідроген гідроксильної групи заміщений на вуглеводневий радикал спирту.
Назви естерів утворюються від назв відповідних кислот і спиртів з додаванням слова естер. Наприклад, естер
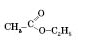
можна назвати етиловий естер оцтової кислоти, за міжнародною систематичною номенклатурою — етилацетат (суфікс -ат).
Загальна формула естерів:
![]()
де R1 — вуглеводневий радикал кислоти (у мурашиній кислоті це атом Гідрогену), R2 — вуглеводневий радикал спирту.
Вуглеводи
— це органічні сполуки, що мають загальну
формулу![]() , де
, де![]() .
.
Вуглеводи поділяються на моносахариди, олігосахариди, полісахариди. Оліго- і полісахариди гідролізуються з утворенням моносахаридів. Моносахариди не можуть гідролізуватися з утворенням найпростіших вуглеводів.
За числом
атомів Карбону моносахариди поділяють
на тетрози
![]() , пентози
, пентози
![]() і гексози
і гексози
![]() .
.
Список використаної літератури
“Основи загальної хімії”. Ю.Д.Третьяков, Ю.Г.Метлін. – Москва: “Освіта”, 1990.
“Загальна хімія”. Н.Л.Глинка. Видавництво “Хімія”, Ленінградське відділення 1992 р.
“Від чого і як руйнуються метали”. С.А.Балезін. - Москва “Освіта”, 1996.
“Посібник по хімії для поступаючих у вузи”. Г.П.Хомченко. 1996.
“Книга для читання по неорганічній хімії”. Частина 2. Укладач В.А.Крицман. Москва “Освіта” 1984 р.
“Хімія і науково-технічний прогрес”. І.Н.Семенов, А.С.Максимов, А.А.Макареня. Москва “Освіта” 1988р.
