
- •1.Будова атомів металів. Положення металів у періодичній системі. Групи металів
- •Фізичні властивості металів
- •2.Загальна характеристика елементів-неметалів
- •Хімічні властивості металів
- •Способи одержання металів
- •Неметали як прості речовини
- •Хімічні властивості неметалів
- •3. Вуглеводи і їхні властивості.
- •Класифікація і розповсюдження
- •Фізико-хімічні властивості.
- •Біологічна роль.
- •4.Оксигеновмісні органічні сполуки
Неметали як прості речовини
Неметалічні елементи утворюють прості речовини, які відрізняються своїм складом.
Будова неметалів. Прості речовини неметали існують у вигляді двохатомних або багатоатомних молекул. Атоми елементів 2-го періоду, а також Гідроген, утворюють між собою хімічні зв'язки лише за рахунок неспарених s-електронів (Гідроген) і p-електронів й тому вони двохатомні, наприклад: водень Н2, кисень О2, азот N2 та молекули галогенів — На12. Виняток становлять бор і вуглець як тверді речовини. Елементи-неметали 3-го періоду утворюють додаткові зв'язки за рахунок вакантних d-орбіталей, тому їхні прості речовини багатоатомні за звичайних умов, наприклад: білий фосфор Р4, сірка S8. Карбон утворює багато зв'язків тому, що в його атомі кількість валентних електронів та орбіталей однакова. Зв'язок між атомами в молекулах — ковалентний неполярний.
Більшість неметалів мають молекулярну структуру (молекулярні кристалічні ґратки), а бор, вуглець (алмаз), силіцій, арсен, селен, телур — атомну структуру (атомні кристалічні ґратки). Деякі неметали мають різні структури, бо існують у вигляді алотропних модифікацій.
Будова речовин впливає на їхні властивості, і насамперед на фізичні.
Фізичні властивості неметалів. Залежність фізичних властивостей неметалів від їхньої будови відображає схема 2.
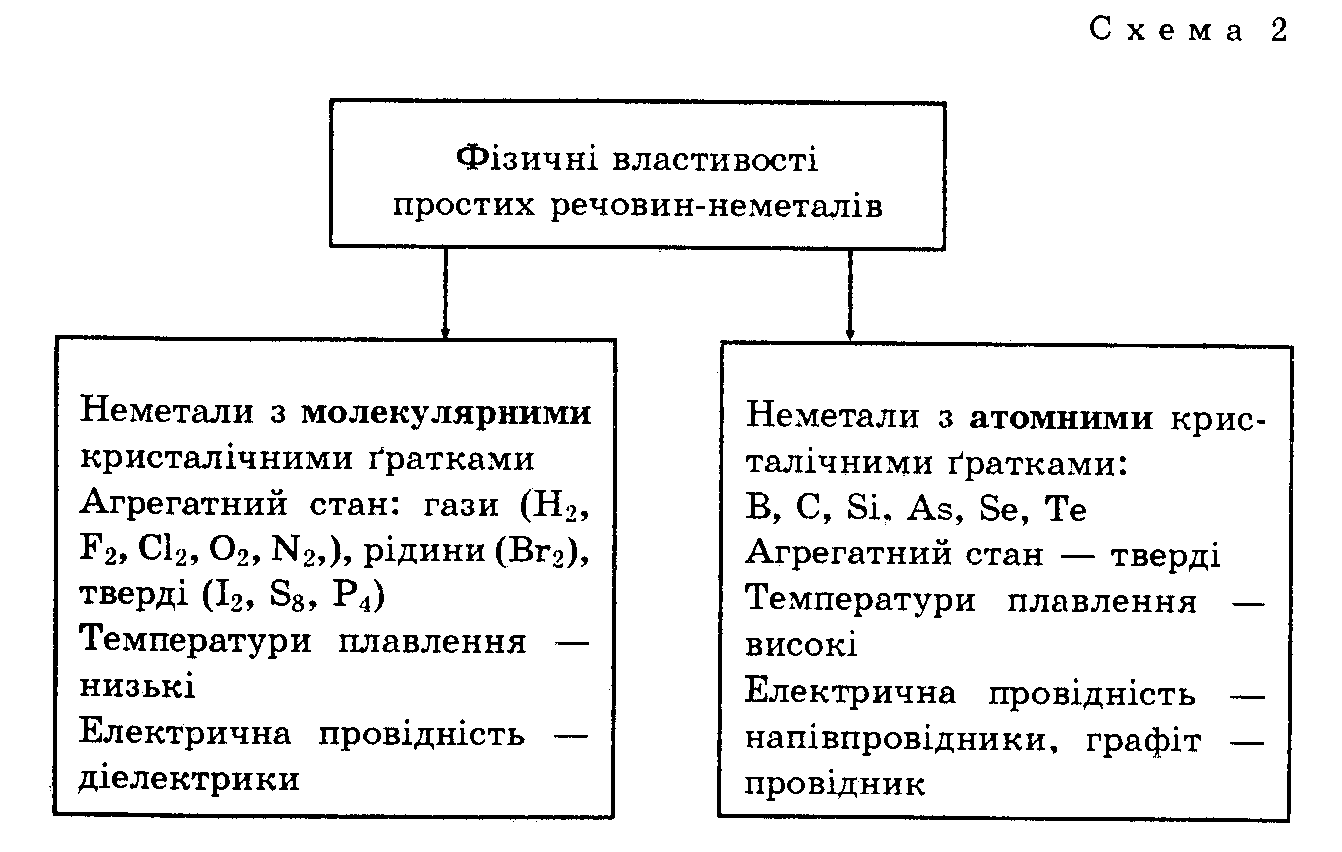
У той же час алотропні модифікації неметалів мають різну будову, що впливає на їхні властивості. Конкретні приклади наведені в таблиці 2.
Зверніть увагу, що лише графіт є електричним провідником. Нині вважають, що електрична провідність — це один із головних критеріїв поділу речовин атомної будови на метали та неметали.
Отже, фізичні властивості неметалів залежать від їхньої будови.
Хімічні властивості неметалів
Хімічні властивості простих речовин-неметалів зумовлені особливостями атомів елементів, що їх утворюють. Так, якщо елементи-неметали — окисники, то й прості речовини-неметали у багатьох реакціях виявляють окиснювальні властивості.
Неметалічні властивості речовин залежать значною мірою від енергії зв'язку між атомами у молекулі. Розглянемо значення енергій зв'язку (кДж/моль) у таких молекулах: хлору Сl2 — 243, кисню О2 — 494, азоту N2 — 945. Чим більше спільних електронних хмар, тим міцніше атоми зв'язані між собою (енергія зв'язку більша). Звідси найбільш активна речовина — хлор, а найменш активна — азот.
Більшість неметалів свою хімічну активність виявляють лише за певних умов.
! Перед тим як розглядати хімічні властивості неметалів, зауважимо, що в природі існує така об'єктивна закономірність: між собою реагують речовини, протилежні за складом і за властивостями.
Виходячи з цього, неважко усвідомити, що неметали реагують з металами, окисники з відновниками (між собою можуть реагувати і два неметали), неметали — прості речовини із складними, неметали як неорганічні речовини з органічними. У всіх перелічених реакціях неметали будуть або окисниками, або відновниками залежно від хімічної природи другого реагенту.
З таблиці видно, що для неметалів характерні реакції сполучення й заміщення. Всі вони окисно-відновні, більшість із них — екзотермічні. Реакції між газоподібними неметалами — обернені. Більшість продуктів реакцій сполучення — ковалентні сполуки з більшою чи меншою часткою іонного зв'язку.
Деякі неметали відрізняються від усіх інших. Так, фтор — це єдиний з неметалів, який виявляє лише окиснювальні властивості. Неметали: бор, вуглець, силіцій та фосфор — відновлюють такі сильні окисники, як азотну і концентровану сірчану кислоти. У реакціях із кислотами кожний із неметалів окиснюється повністю, ступінь окиснення металу стає максимально позитивним.
У деяких неметалів залежно від умов відбувається одночасно збільшення і зменшення ступеня окиснення одного й того ж елемента. Наприклад, у реакції розчинення хлору у воді або розчині гідроксиду натрію атоми Хлору як віддають електрони (відновники), так і приєднують електрони (окисники):
C12 + H2O HC1 + HC1O
о
Cl - le Cl (процес окиснення, Cl — відновник)
Cl + 1e Cl (процес відновлення, Cl — окисник)
Такі реакції належать до реакцій самоокиснення — самовідновлення, або диспропорціювання.
Отже, залежно від умов неметали у хімічних реакціях можуть бути як окисниками - в більшості випадків,- так i відновниками.
