
- •1. Химия, как одна из наук о природе. Предмет и задачи химии.
- •2. Основные законы стехиометрии.
- •3. Понятие о растворах. Виды растворов.
- •4. Растворение. Растворимость. Гидратная теория д.И. Менделеева.
- •5.Способы выражения состава растворов.
- •6. Свойства растворов неэлектролитов. Законы Генри, Рауля, Вант-Гоффа.
- •9. Константа и степень электролитической диссоциации. Активность и ионная сила.
- •10.Вода как слабый электролит. Ионное произведение воды.
- •11. PH растворов сильных и слабых кислот и оснований
- •12.Гидролиз солей. Типы гидролизующихся солей. Константа и степень гидролиза.
- •13. Буферные растворы: их состав и применение
- •14. Буферные системы организма
- •Фосфатная буферная система
- •Белковая буферная система
- •Гемоглобиновая буферная система
- •15. Основные понятия химической термодинамики. Типы термодинамических систем.
- •16. Первый и второй законы химической термодинамики. Внутренняя энергия, энтальпия,энтропия.
- •17. Тепловой эффект химической реакции. Закон Гесса. Экзо- и эндотермические процессы.
- •18. Определение скорости химической реакции в гомогенных и гетерогенных системах.
- •19.Зависимость скорости химической реакции от концентраций реагирующих веществ. Закон действия масс.
- •20. Зависимость скорости химической реакции от температуры и природы реагирующих веществ. Правило Вант-Гоффа. Энергия активации.
- •22. Обратимые и необратимые химические реакции. Химическое равновесие. Принцип Ле-Шателье.
- •23) Ядерная модель атома Резерфорда
- •24) Строение атома по н.Бору. Постулаты Бора.
- •25. Квантово-механическая модель атома.
- •26. Типы атомных орбиталей. Характеристика квантовых чисел.
- •27.Заполнение электронами орбиталей в многоэлектронных атомах. Принцип Паули, правило Хунда, правило Клечковского.
- •28. Основные характеристики химической связи: энергия связи, кратность связи, длина связи, полярность связи.
- •Полярность связи
- •29.Метод валентных связей для описания образования химической связи в молекулах. Гибридизация атомных орбиталей.
- •30.Метод молекулярных орбиталей для описания образования химической связи в молекулах.
- •31. Основные характеристики молекул: полярность и поляризуемость молекул.
- •33. Ионная связь. Полярность связи.
- •34. Металлическая связь. Общие свойства веществ с металлической кристаллической решеткой.
- •35. Водородная связь и ее роль в живых системах.
- •36.Виды межмолекулярного взаимодействия:ориентационное, индукционное, дисперсионное.
- •37. Комплексные соединения. Координационная теория Вернера.
- •38. Типы комплексных соединений. Номенклатура комплексных соединений.
- •39. Классификация комплексных соединений
- •40 Устойчивость комплексных соединений. Диссоциация комплексных соединений. Константы нестойкости и устойчивости комплексных соединений.
- •41. Биологическая роль комплексных соединений. Металлоферменты
- •43 Электродные потенциалы и электродвижущие силы
- •44 Водородный электрод. Гальванические элементы.
- •45.Окислительно- восстановительные потенциалы. Направление овр
- •46.Электролиз. Вида электролиза.
- •47.Химические источники электрической энергии. Гальванические элементы и аккамуляторы.
- •48. Коррозия металлов. Виды коррозионного разрушения. Защита от коррозии. Химическая коррозия
- •Примеры коррозии
- •49. Гетерогенное равновесие. Растворимость малорасторимых соединений.
- •50. Произведение растворимости малорастворимых соединений. Условия образования и растворения осадков
- •51. Гетерогенные равновесия «раствор-газ» «раствор-осадок» в организме в норме и паталогии
- •Вопрос 52: Водород. Физико-химические свойства. Вода в природе и как неотъемлемая среда биосистем.
- •Вопрос 53: Физико-химические свойства воды. Основные показатели качества природных вод.
- •54 Вопрос: Изотопы водорода в природе. Тяжёлая вода и её влияние на организм.
- •56. Биологическая роль ионов щелочных металлов и применение их соединений в медицинской практике
- •57. Общая характеристика элементов 2 а группы. Жесткость природных вод.
- •58. Соединения элементов 2 а группы в медицине. Биологическая роль кальция и магния
- •59. Изотопы. Радиоактивные изотопы в медицине. Проблема стронция 90
- •60. Общая характеристика 3 а группы. Бор и аллюминий в медицине
- •61.Общая характеристика 4 а группы. Углерод, его соединения, аллотропные модификации. Круговорот углерода
- •63. Общая характеристика элементов 4 а группы. Физико-химические свойства. Применнение в медицине. Силикагели как адсорбенты.
- •65. Общая характеристика элементов vа группы. Азот соединения азота. Химические превращения соединений азота в атмосфере и биосфере.
- •66. Общая характеристика элементов vа группы. Соединения азота как медицинские препараты. Аммиак, соли аммония, мочевина, мочевая кислота как продукты метаболизма организма.
- •67. Общая характеристика элементов главной подгруппы V группы
- •69.Общая характеристика элементов VI группы
- •Вопрос 73. Общая характеристика элементов 7а группы. Фтор, хлор, бром, йод. Галогены и их соединения в природе.
- •Вопрос 74. Общая характеристика элементов 7а группы. Биологическая роль и применение в медицине галогенов и их соединений.
- •Вопрос 75 Общая характеристика элементов 8а группы. Связь хим свойств со строением их атомов. Возможность образования соединений с другими элементами. Применение в медицинской практике.
- •77. Свойства металлов подгруппы цинка
- •78 Металлы III группы главной подгруппы
- •79.Общая хар-ка элементов 4б группы.Титан, цирконий, гафний.Нахождение в природе.Применение в мед.Практике.
- •80.Общая хар-ка элементов 5б группы. Ванадий, ниобий, тантал..Нахождение в природе.Применение в мед.Практике.
- •81. Общая хар-ка элементов 6б группы. Хром, молибден, вольфрам.Важнейшие соединения. Участие в хим.Процессах организма.
- •Соединения двухвалентного молибдена.
- •Соединения трехвалентного молибдена.
- •Соединения четырехвалентного молибдена.
- •Важнейшие соединения вольфрама. Соединения двухвалентного вольфрама.
- •Соединения четырехвалентного вольфрама.
- •Соединения пятивалентного вольфрама.
- •Соединения шестивалентного вольфрама.
16. Первый и второй законы химической термодинамики. Внутренняя энергия, энтальпия,энтропия.
В каждом теле, в каждом веществе в скрытом виде заключена внутренняя энергия, которая складывается из энергии движения и взаимодействия атомов, молекул, ядер и других частиц, внутриядерную и другие виды энергии, кроме кинетической энергии движения системы, и потенциальной энергии ее положения. Абсолютную величину внутренней энергии определить невозможно. Она представляет собой способность системы к совершению работы или передаче теплоты. Однако можно определить ее изменение U при переходе из одного состояния в другое:
ΔU = U2 - U1 ,
где U2 и U1- внутренняя энергия системы в конечном и начальном состояниях. Если ΔU > 0 –внутренняя энергия системы возрастает, если ΔU < 0 – внутренняя энергия системы убывает. U – термодинамическая функция состояния, так как ее количество не будет зависеть от пути и способа перехода системы, а будет определяться лишь разностью в этих состояниях. При переходе из одного состояния в другое система может обмениваться с окружающей средой веществом или энергией в форме теплоты и работы.
Теплота Q представляет собой количественную меру хаотического движения частиц данной системы или тела. Энергия более нагретого тела в форме теплоты передается менее нагретому телу. При этом не происходит переноса вещества.
Работа А является количественной мерой направленного движения частиц, мерой энергии, передаваемой от одной системы к другой за счет перемещения вещества от одной системы к другой под действием тех или иных сил, например гравитационных. Теплоту и работу измеряют в джоулях (Дж), килоджоулях (кДж) и мегаджоулях (МДж). Положительной считается работа, совершаемая системой против внешних сил (А > 0) и теплота, подводимая к системе (Q > 0). Теплота и работа зависят от способа проведения процесса, т.е. они являются функциями пути.
Количественное соотношение между изменением внутренней энергии, теплотой и работой устанавливает первый закон термодинамики:
Q = ΔU + А.
Если к системе подводится теплота Q, то она расходуется на изменение внутренней энергии системы ΔU и на совершение системой работы А над окружающей средой.
Теплоту и работу можно измерить, отсюда,
ΔU = Q – А.
Первый закон термодинамики является формой выражения закона сохранения энергии. Согласно этому закону, энергия не может ни создаваться, ни исчезать, но может превращаться из одной формы в другую. Его справедливость доказана многовековым опытом человечества.
Если система осуществляет переход из одного состояния в другое при постоянном объеме ( реакция протекает в автоклаве), то работа расширения системы
А = рΔV = 0
и
Qv = ΔU = U2 – U1,
т.е. если реакция протекает при постоянном объеме, то выделение или поглощение теплоты Q связано с изменением внутренней энергии системы.
Если на систему не действуют ни какие другие силы, кроме постоянного давления, т.е. химический процесс осуществляется в изобарных условиях, и единственным видом работы является работа расширения, то первый закон термодинамики запишется:
Qp = ΔU + pΔV.
Подставив ΔU = U2 ‑ U1, получим:
Qp = U2 ‑ U1 + pV2 ‑ pV1 = (U2 + pV2) ‑ (U1 + pV1).
Характеристическая функция
U + pV = H
называется
энтальпией
системы. Энтальпия – показывает убыль
хим. энергии в продуктах по сравнению
с исходными веществами. Она равна по
величине и обратна по знаку тепловому
эффекту хим. реакции.
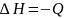
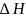 <0-для
экзотермических процессов.
<0-для
экзотермических процессов.
> 0 – для эндотермических процессов.
 стандартная
энтальпия образования в-ва.
стандартная
энтальпия образования в-ва.
 -
стандартная энтальпия сгорания вещества.
-
стандартная энтальпия сгорания вещества.
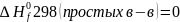
Qp = H2 - H1, и Qp = ΔH.
В случае изобарического процесса теплота, подведенная к системе, равна изменению энтальпии системы.
Абсолютное значение энтальпии системы определить невозможно, но экспериментально можно определить Qp, т.е. изменение энтальпии ΔН, при переходе из одного состояния в другое. Н -это термодинамическая функция состояния. Если ΔН > 0 - энтальпия системы возрастает, если ΔН < 0-энтальпия системы уменьшается, т.е. теплота выделяется системой.
Как и другие характеристические функции, энтальпия зависит от количества вещества, поэтому ее изменение ΔН, обычно относят к 1 моль и выражают в кДж/моль.
2 закон термодинамики
В изолированных системах самопроизвольно протекают только те процессы, которые сопровождаются ростом энтропии системы.
В
справочниках приводится, так называемая,
стандартная
энтропия
![]() вещества,
находящегося в стандартном состоянии
при температуре 298,15 К. Т.к. энтропия
является функцией состояния системы,
то для реакции, протекающей в стандартных
условиях,
вещества,
находящегося в стандартном состоянии
при температуре 298,15 К. Т.к. энтропия
является функцией состояния системы,
то для реакции, протекающей в стандартных
условиях,
bB + dD = lL + mM
изменение энтропии (энтропия реакции) можно рассчитать как разницу между суммарной энтропией продуктов реакции и исходных веществ с учетом стехиометрических коэффициентов в соответствии с уравнением
 ,
,
где nj, mi – коэффициенты уравнения реакции для продуктов и исходных веществ;
![]() -
стандартные энтропии
продуктов
реакции и исходных веществ, соответственно.
-
стандартные энтропии
продуктов
реакции и исходных веществ, соответственно.
Энтропия растет (ΔS > 0) в процессах, связанных с повышением температуры, при плавлении вещества, при испарении, при расширении системы, растворении. В этих случаях увеличение числа частиц и энергии теплового движения увеличивает беспорядок и, следовательно, увеличивается энтропия, и наоборот – охлаждение, конденсация, кристаллизация, реакции с уменьшением объема – сопровождаются уменьшением энтропии (ΔS < 0). "Носителями" энтропии являются газы, обладающие высокими значениями энтропии.
