
- •55. Физико–химический анализ. Электрохимические методы анализа. Назвать и объяснить на чем они основаны.
- •54. Химические и физико-химические методы анализа. Общая характеристика химических методов анализа. Аналитический сигнал.
- •53. Химическая идентификация. Качественный анализ на примере анализа природной воды.
- •51. Методы защиты коррозии: защитные покрытия, электрозащита, применение ингибиторов коррозии.
- •50. Коррозия металлов. Коррозия химическая и электрохимическая. Механизм протекания электрохимической коррозии. Коррозия с выделением водорода и восстановлением кислорода.
- •49. Гальванический элемент. Реакции, протекающие при работе гальванического элемента. Примеры.
- •48. Электродный потенциал. Ряд напряжений. Уравнение Нернста.
- •47. Стандартный водородный электрод. Его применение. Измерение электродных потенциалов металлических электродов.
- •45. Электрохимические процессы. Электродный потенциал ряд стандартных электродных потенциалов металлов. Уравнение Нернста.
48. Электродный потенциал. Ряд напряжений. Уравнение Нернста.
Электродный потенциал
Электродный потенциал - разность электростатичких потенциалов между электродом и находящимся с ним в контакте электролитом. Возникновение электродного потенциала обусловлено пространственным разделением зарядов противоположного знака на границе раздела фаз и образованием двойного электрического слоя. На границе между металлич. электродом и р-ром электролита пространств. разделение зарядов связано со след. явлениями: переносом ионов из металла в р-р в ходе установления электрохим. равновесия, кулоновской адсорбцией ионов из р-ра на пов-сть металла, смещением электронного газа за пределы положительно заряженного ионного остова кристаллич. решетки, специфич. (некулоновской) адсорбцией ионов или полярных молекул р-рителя на электроде и др. Последние два явления приводят к тому, что электродный потенциал не равен нулю даже при условиях, когда заряд пов-сти металла равен нулю .
Ряд напряжений - последовательность расположения металлов и их ионов в порядке возрастания стандартных электродных потенциалов в растворах электролитов. Электродом сравнения обычно служит стандартный водородный электрод. Поэтому в Р. н. включают и водород, электродный потенциал которого принимается равным нулю. Наибольшие отрицательные потенциалы характерны для щелочных металлов (около — 3 в), за ними следуют щёлочноземельные металлы и т. д.; наиболее положительные потенциалы имеют благородные металлы (около + 1,5 в; численные значения). В Р. н. часто включают неметаллы, ионы и некоторые химические соединения. Наиболее распространённые металлы расположены в Р. н. в следующей последовательности: Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au.
Уравнение Нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
![]() ,
,
где
![]() —
электродный потенциал,
—
электродный потенциал, ![]() —
стандартный электродный потенциал,
измеряется в вольтах;
—
стандартный электродный потенциал,
измеряется в вольтах;
![]() — универсальная
газовая постоянная, равная 8.31 Дж/(моль·K);
— универсальная
газовая постоянная, равная 8.31 Дж/(моль·K);
![]() —
абсолютная температура;
—
абсолютная температура;
![]() — постоянная
Фарадея, равная 96485,35 Кл·моль−1;
— постоянная
Фарадея, равная 96485,35 Кл·моль−1;
![]() —
число моль электронов, участвующих
в процессе;
—
число моль электронов, участвующих
в процессе;
![]() и
и ![]() — активности соответственно окисленной
и восстановленной форм вещества,
участвующего в полуреакции.
— активности соответственно окисленной
и восстановленной форм вещества,
участвующего в полуреакции.
Если в формулу Нернста
подставить числовые значения
констант ![]() и
и ![]() и
перейти от натуральных
логарифмов к десятичным, то
при
и
перейти от натуральных
логарифмов к десятичным, то
при ![]() получим
получим
![]()
47. Стандартный водородный электрод. Его применение. Измерение электродных потенциалов металлических электродов.
Стандартный водородный электрод - это специально сконструированной электрод, в котором происходит окислительно-восстановительная реакция: 2Н+ + 2е ↔ Н2. При этом концентрация ионов водорода является одномолярной, давление водорода равняется 1 атм. и поддерживается температура 25°С.
Стандартный водородный
электрод представляет собой сосуд,
заполненный кислотой (как правило), в
котором находится платиновая пластинка,
служащая для адсорбции молекулярного
водорода и его диссоциации на атомы, а
также являющаяся проводником первого
рода, поставляющим в систему свободные
электроны. Концентрация кислоты
соответствует
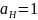 , парциальное давление водорода в системе
поддерживается 10^5 Па.
, парциальное давление водорода в системе
поддерживается 10^5 Па.
Измерение электродных потенциалов металлических электродов.
Точно измерить электродный потенциал достаточно трудно, так как необходимо, чтобы в процессе измерения не нарушалось равновесие на электродах. По этой причине невозможно получить точное значение Е с помощью обычного вольтметра: если мы замкнем цепь, используя вместо проводника вольтметр, то в ней начнет протекать довольно большой ток, который нарушит равновесие на электродах. Для измерения можно использовать специальные вольтметры с высоким входным сопротивлением (более 1012 Ом). При включении в цепь такого прибора протекающий ток слишком мал для оказания существенного влияния на электродное равновесие. Стандартный электродный потенциал-это потенциал электрода при стандартных условиях, его обозначают символом Е°. Эти потенциалы определены для многих окислительно-восстановительных систем и обычно приводятся в химических справочниках. Если электроды (на пример, металлические электроды 1-го рода) расположить в порядке возрастания потенциала, то мы получим таблицу, называемую рядом стандартных электродных потенциалов. Этот ряд часто называют рядом напряжений, однако этот термин устарел и его лучше не использовать.

При помощи ряда стандартных электродных потенциалов можно характеризовать некоторые химические свойства металлов. Например, его применяют для выяснения, в какой последовательности восстанавливаются ионы металлов при электролизе, а также при описании других свойств металлов. Чем меньше алгебраическая величина потенциала, тем выше восстановительная способностьэтого металла и тем ниже окислительная способность его ионов. Как следует из этого ряда, металлический литий - самый сильный восстановитель, а золото-самый слабый. И наоборот, ион золота Аu3+-самый сильный окислитель, а ион лития Li+ -самый слабый. Каждый металл в ряду стандартных электродных потенциалов обладает способностью вытеснять все следующие за ним металлы из растворов их солей. Однако это не означает, что вытеснение обязательно происходит во всех случаях. Например, алюминий вытесняет медь из раствора хлорида меди (II) СuСl2, но практически не вытесняет ее из раствора сульфата меди (II) CuS04. Это объясняется тем, что хлорид-ион Сl-быстро разрушает защитную поверхностную пленку на алюминии, а сульфат-ион SO4 2-практически не разрушает ее. Все металлы, имеющие отрицательные значения стандартных электродных потенциалов, т.е. стоящие в ряду до водорода, вытесняют водород из разбавленных кислот, анионы которых не проявляют окислительных свойств (например, из НСl или разбавленной H2S04) и растворяются в них. Однако есть и исключения. Например, свинец практически не растворяется в серной кислоте. Это обусловлено образованием на поверхности металла защитной пленки труднорастворимого сульфата свинца PbS04, который затрудняет контакт металла с раствором кислоты. Поэтому можно сделать вывод, что пользоваться рядом стандартных электродных потенциалов следует с учетом всех особенностей рассматриваемых процессов.
46. Электрохимия. Механизм возникновения скачка потенциала на границе раздела фаз: металл/растворов соли металла. Ряд напряжений. Использование этого ряда для определения направления реакции окисления-восстановления.
Электрохимия — раздел химической науки, в котором рассматриваются системы и межфазные границы при протекании через них электрического тока, исследуются процессы в проводниках, на электродах (из металлов или полупроводников, включая графит) и в ионных проводниках (электролитах). Электрохимия исследует процессы окисления и восстановления, протекающие на пространственно-разделённых электродах, перенос ионов и электронов. Прямой перенос заряда с молекулы на молекулу в электрохимии не рассматривается.
Возникновение скачка потенциала на границе раздела фаз вызывается различными причинами, зависящими от природы граничащих фаз. Одной из наиболее общих причин будет обмен заряженными частицами. В момент появления контакта между фазами он протекает преимущественно в каком-либо одном направлении, в результате чего создается избыток частиц данного знака заряда по одну сторону границы раздела и их недостаток по другую. Такой нескомпенсированный обмен приводит к созданию двойного электрического слоя, а следовательно, к появлению разности потенциалов. Последняя в свою очередь будет влиять на кинетику обмена, выравнивая скорости перехода заряженных частиц в обоих направлениях. По мере увеличения разности потенциалов наступит момент, когда уже не будет больше преимущественного перехода частиц из одной фазы в другую, и скорости их перехода в обоих направлениях станут одинаковыми. Такое значение скачка потенциала отвечает равновесию между фазами, при котором электрохимические потенциалы заряженных частиц в обеих фазах равны. Заряженными частицами, принимающими участие в обмене между фазами, могут быть положительные и отрицательные ионы, а также электроны. Какие именно частицы переходят из одной фазы в другую и тем самым обусловливают возникновение скачка потенциала, определяется природой граничащих фаз. На границах металл - вакуум или металл / - металл 2 такими частицами являются обычно электроны. При создании границы металл - раствор соли металла в обмене участвуют катионы металла. Скачок потенциала на границах стекло - раствор, а также ионообменная смола - раствор появляется в результате обмена, в котором участвуют два сорта одноименно заряженных ионов. На границах стекло-раствор и катионитная смола - раствор такими ионами являются ионы щелочного металла и водорода; на границе анионитная смола - раствор - ион гидроксила и какой-либо другой анион. При контакте двух не смешивающихся жидкостей, каждая из которых содержит в растворенном виде один и тот же электролит, потенциал возникает за счет неэквивалентного перехода обоих ионов электролита из одной фазы в другую подобно тому, как образуется диффузионный потенциал. Следовательно, оба потенциала - и фазовый жидкостный, и диффузионный - не являются равновесными.
Ряд напряжений - последовательность расположения металлов и их ионов в порядке возрастания стандартных электродных потенциалов в растворах электролитов. Электродом сравнения обычно служит стандартный водородный электрод. Поэтому в Р. н. включают и водород, электродный потенциал которого принимается равным нулю. Наибольшие отрицательные потенциалы характерны для щелочных металлов (около — 3 в), за ними следуют щёлочноземельные металлы и т. д.; наиболее положительные потенциалы имеют благородные металлы (около + 1,5 в; численные значения). В Р. н. часто включают неметаллы, ионы и некоторые химические соединения. Наиболее распространённые металлы расположены в Р. н. в следующей последовательности: Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au.
