
- •Пакет лекцій
- •Неполярний радикал
- •Полярний незаряджений радикал
- •Полярний заряджений радикал
- •1. Кислотно-основні властивості білків
- •2. Розчинність білків
- •3. Денатурація білків
- •6. Скорочувальна функція
- •7. Захисна функція
- •Лекція тема. Обмін вуглеводів: синтез та розпад глікогена, гліколіз, глікогеноліз. Цикл кребса
- •Література
- •Лекція 4
- •Література
- •Лекція 6
- •Література
- •Класифікація і номенклатура
- •Жиророзчинні вітаміни
- •Водорозчинні вітаміни
- •Лекція 5
- •Література
- •Лекція 7
- •Література
1. Кислотно-основні властивості білків
Більшість білків розчинні у воді і є амфотерними електролітами. Вони містять групи як кислотного, так і основного характеру, тобто є біполярними йонами. Їх заряд залежить від кількості цих груп і рН середовища:
рН<7 рН»7 рН>7
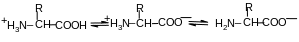
катіон біполярний йон аніон
2. Розчинність білків
Розчинність окремих білків у різних середовищах залежить від переважання в їх складі полярних або неполярних амінокислотних залишків. Багато глобулярних білків (зокрема, білків сироватки крові та інших біологічних рідин) містять на своїй поверхні гідрофільні залишки полярних незаряджених або заряджених амінокислот, які добре взаємодіють із дипольними молекулами води, утворюючи навколо білкових молекул гідратні оболонки. Ці білки добре розчинні у воді або слабких сольових розчинах солей лужних металів.
3. Денатурація білків
Під денатурацією розуміють втрату білковою молекулою притаманної їй просторової структури (натиної конформації) та порушення характерних для даного білка фізико-хімічних властивостей. Денатурація супроводжується зниженням або втратою специфічної для даного білка біологічної активності (ферментативної, гормональної тощо).
Вона відбувається внаслідок впливу на білкові розчини та білки, що знаходяться в біологічних середовищах, жорстких хімічних, фізико-хімічних та фізичних факторів. Денатурацію викликають дія кислот, лугів, органічних розчинників, нагрівання білків до 60-80°С, дія високих доз ІФ та іонізуючого випромінювання. Механізм впливу денатуруючих агентів полягає в руйнуванні слабких зв'язків (водневих, іонних, дипольних, гідрофобних), що стабілізують упорядковані типи просторової організації білкових молекул (2-ну та 3-ну структуру).
Прості та складні білки
Білки, до складу яких входять лише залишки амінокислот, об'єднані в поліпептидні ланцюги, отримали назву простих білків або протеїнів. Білки, до складу яких входять приєднані ковалентними або не ковалентними зв'язками інші біомолекули або іони металів, називаються складними білками або протеїдами. Тобто, прості білки побудовані тільки з залишків амінокислот, а складні - з простого білку і зв'язаної з ним якоїсь сполуки небілкової природи.
Сполуками не амінокислотної природи, що входять до складу складних білків (простетичними групами) можуть бути вуглеводи, ліпіди, нуклеїнові кислоти, іони металів, залишки фосфорної кислоти. Простетична група може бути з'єднана з білковою частиною (апопротеїном) як ковалентними зв'язками, так і не ковалентними (водневими, іонними, гідрофобними).
Протеїни (прості білки) поділяються на групи залежно від їх розчинності в різних розчинниках. Найбільш поширені глобулярні білки - альбуміни, глобуліни, гістони, протаміни, проламіни, фібрілярні білки - фібриноген, міозин, актин.
Альбуміни — добре розчиняються у воді, але не розчиняються в насиченому розчині амоній сульфату. Дуже поширені у тваринному і рослинному світі. Мають відносно велику молекулярну масу, характеризуються підвищеним вмістом лейцину і дуже малою кількістю гліцину. Вони є складовими компонентами крові, м'язів, молока, цитоплазми майже всіх клітин. Типовими представниками є овальбумін курячого яйця, лактоальбумін молока, сірко альбумін сироватки крові.
Глобуліни нерозчинні у воді і слабких кислотах, випадають в осад при 50-процентній концентрації амоній сульфату. Добре розчиняються у слабких розчинах нейтральних солей. Глобуліни містять велику кількість гліцину. Вони дуже поширені в організмі тварин і рослин. У вищих організмах глобуліни виконують роль захисних білків, з них утворюються антитіла. У крові людини міститься декілька типів глобулінів - α¯, β¯, γ¯. Деякі з них здійснюють перенесення іонів металів у плазмі: трансфери транспортує залізо, церулоплазмін - мідь.
Попони - низькомолекулярні білки, розчинні у воді і кислих розчинах, при додаванні амоніаку легко випадають в осад. Гістони характеризуються підвищеними вмістом аргініну і лізину. Вони локалізовані в ядрі і відіграють важливу біологічну роль в організмі. З'єднуючись з нуклеїновими кислотами, вони зумовлюють їх унікальну структуру, необхідну для біосинтезу білків.
Протаміни - низькомолекулярні білки, розчинні у воді і кислих розчинах, мають добре виражений основний характер. Протаміни містять більше аргініну і лізину, ніж пістони - до 50-80%. Значна кількість протамінів знаходиться в спермі риб, печінці, селезінці, нирках та залозах внутрішньої секреції. Біологічна роль така ж, як і гістонів.
Глутеліни - рослинні білки. Розчиняються у розведених розчинах лугів і кислот. Містять у значних кількостях глютамінову кислоту і лізин. Глутеліни є цінними харчовими білками.
Проламіни — рослинні білки. Погано розчиняються у воді, добре у 60-80% етиловому спирті. ЦІ білки містять до 10-15% проліну і 20-50% глутамінової кислоти. Проламіни - цінні продукти харчування. Це гліадин пшениці й жита, гордеїн ячменя, аверін вівса й інші.
Фібриноген - фібрилярний білок, розчинний в концентрованих сольових розчинах І нерозчинний у воді. Є складовою частиною плазми крові і виконує захисну функцію. У результаті складних хімічних реакцій фібриноген перетворюється у фібрин, який утворює широку мережу розгалужених ниток. У цих нитках осідають еритроцити крові, у результаті чого утворюється згусток (тромб), що перешкоджає втраті крові організмом.
Актин і міозин - водонерозчинні фібрилярні білки, з яких складаються міофібрили - скорочувальні елементи клітин м'язової тканини.
Відома ще одна група білків - протеноїди або склеропротеїди. Ці білки дуже міцні й еластичні, не розчиняються у воді, розчинах кислот, лугів, солей, не розщеплюються ферментами. Входять до складу опірної і покривної тканини (кісток, хрящів, сухожиль, волосся, шкіри) і належать до фібрилярних білків.
В організмі більше всього міститься кологену, який є основним білковим компонентом шкіри, сухожилля, хрящів. Кологен за міцністю може зрівнятися зі сталевим дротом. До складу цього білка входить підвищена кількість гліцину (30% суми АК), а також оксипролін і оксилізин. У процесі тривалого кип'ятіння колаген перетворюється в желатин.
У великих артеріях міститься інший білок - еластин, також багатий гліцином і проліном. Особливістю цього білка є здатність до розтягнення. Основним білковим компонентом волосся, нігтів і шерсті є кератин, шовку -фіброїн.
Протеїди поділяються на групи залежно від природи їх небілкової частини (простетичної групи).
Хромопротеїди -- складні білки, молекули яких містять простий білок і забарвлену простетичну групу (різні кольорові сполуки: вітамін В2, каротин, порфірин).
Багато хромопротеїдів у складі небілкової групи містять метали (метал опротеїди).
В організмі людини і вищих тварин одним Із більш важливих хромопротеїдів є гемоглобін — червоний залізовмісний білок, який має властивість переносити гази з токами крові.
Фосфопротеїди - складні білки, у молекулах яких білок зв'язаний з фосфатною кислотою.
Найбільш вивченим фосфатоїдом є казеїн — білок молока. Це цінна харчова речовина для людини і тварин. До фосфатоїдів належить пепсин -основний фермент шлункового соку, який розщеплює білки до пептидів, овальбумін - білок курячого яйця і білки жовтка вітелін, фосфовітин.
Глікопротеїди - складні білки, до складу яких входять вуглеводи і їх похідні (маноза, галактоза, гепарин, глюкуронова кислота). Вони відіграють дуже важливу роль у багатьох фізіологічних процесах організму людини і тварин. Глікопротеїди входять до складу хрящової і сполучної тканини, зв'язок і сухожилля. ЦІ глюкопротеїди називають мукоїдами,
Глікопротеїди муцини - слизуваті виділення травного каналу (слина, шлункові і кишкові слизи). Вони виконують захисну функцію, захищаючи стінки органів травного каналу від механічних і хімічних ушкоджень.
Нуклеопротеїди - одна з найважливіших груп білків. Вони являють собою сполуки білків з нуклеїновими кислотами. Нуклеїнові кислоти як складова частина нуклеопротеїдів і як індивідуальні речовини виконують важливу роль у життєдіяльності організмів. Вони забезпечують збереження і передачу спадкових властивостей, беруть участь у біосинтезі білків у клітинах.
Питання 3. Функції білків
1. Ферментативна (каталітична) функція
Усі ферменти (біокаталізатори) за своєю хімічного природою є білками або комплексами білків із низькомолекулярними небілковими сполуками (коферментами, кофакторами).
2. Структурна функція
Білки входять до структури біомсмбран, становлять основу цитоскелета (мікротрабекулярна сітка, мікрофіламенти), міжклітинного матриксу (колаген, еластин) та певних спеціалізованих тканин (кератини).
3. Регуляторна функція
Білкову та пептидну природу мають численні біорегулятори - гормони, медіатори та модулятори, що виробляються в ендокринній системі, нейронах головного мозку, імунній системі: прості білки (інсулін, глюкагон тощо), глікопротеїни (тропні гормони гіпофіза тощо), низькомолекулярні пептиди (окситоцин, вазопресин, опіоїдні пептиди мозку, пептиди тимоцитів тощо).
4. Рецепторна функція
Білкову природу мають мембранні рецептори для фізіологічно активних сполук, що приймають хімічний сигнал від гормонів, нейромедіаторІв (адренорецептори, холінорецептори, гістамінові рецептори тощо).
5. Транспортна функція
Білки зв'язують та здійснюють міжклітинний та внутрішньоклітинний (трансмембранний, цитогшазматичний) транспорт різних, іонів металів, чужорідних хімічних сполук (ксенобіотиків). Транспортними білками крові людини є сироваткові альбуміни (переносять жирні кислоти, білірубін, лікарські та токсичні сполуки), гемоглобін еритроцитів (транспортує кисень), ліпопротеїни (транспортують ліпіди), трансферин (транспортує залізо).
