
- •Пакет лекцій
- •Неполярний радикал
- •Полярний незаряджений радикал
- •Полярний заряджений радикал
- •1. Кислотно-основні властивості білків
- •2. Розчинність білків
- •3. Денатурація білків
- •6. Скорочувальна функція
- •7. Захисна функція
- •Лекція тема. Обмін вуглеводів: синтез та розпад глікогена, гліколіз, глікогеноліз. Цикл кребса
- •Література
- •Лекція 4
- •Література
- •Лекція 6
- •Література
- •Класифікація і номенклатура
- •Жиророзчинні вітаміни
- •Водорозчинні вітаміни
- •Лекція 5
- •Література
- •Лекція 7
- •Література
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ КРИВОРІЗЬКИЙ КОЛЕДЖ ЕКОНОМІКИ ТА УПРАВЛІНН
ДЕРЖАВНОГО ВИЩОГО НАВЧАЛЬНОГО ЗАКЛАДУ
"КИЇВСЬКИЙ НАЦІОНАЛЬНИЙ ЕКОНОМІЧНИЙ УНІВЕРСИТЕТ
ІМЕНІ ВАДИМА ГЕТЬМАНА"
Пакет лекцій
з дисципліни: «Біохімія»
для студентів спеціальностей:
5.091711 «Виробництво харчової продукції»
(шифр, назва спеціальності)
Склав викладач:
Глущенко О.Л.
Розглянуто і схвалено
на засіданні комісії природничих дисциплін Протокол № від
Голова комісії В.П. Зленко
м. Кривий Ріг
ЛЕКЦІЯ 1
ТЕМА. СВІТ НАЙСКЛАДНІШОГО ЖИТТЯ
Мета: розширити знання студентів про біохімію як науку, що вивчає склад, будову, властивості речовин живої природи, розглянути основні методи біохімічних досліджень, формувати пізнавальний інтерес до вивчення дисципліни та майбутньої професії, розвивати наукові погляди студентів на сутність життя.
План
Біологічна хімія як наука. Предмети та об'єкти вивчення біохімії.
Історія розвитку біологічної хімії.
Методи біохімічних досліджень.
Місце біологічної хімії в системі наук.
Література
Губський Ю.І. Біологічна хімія: Підручник. Київ-Тернопіль: Укрмедкнига, 2000. - С. 7-11.
Мардашко А. А., Миронович Л. М., Степанов Г. Ф.Биологическая и биоорганическая химия: Учебное пособие - К.: Каравелла,2008. -
С. 3-10.
Явоненко О.Ф., Яковенко Б.В. Біохімія: Підручник для студентів спеціальності «Фізична культура» педагогічних університетів. – Суми: ВТД «Університетська книга», 2002. - С. 4-7.
Питання 1. Біологічна хімія як наука. Предмети та об'єкти вивчення біохімії
З давніх часів людина намагалася розпізнати таємницю життя. Йшли роки, тисячоліття, а таємниця не давалася в руки. У кінці XVIII століття проблемою вивчення живого поряд з біологами почали займатися вчені-хіміки. Вони підійшли до її розв'язання зі свого «хімічного» боку. Звідси бере початок наука, що дістала назву органічної хімії. Спочатку вченим вдалося довести, що складні речовини, виділені з живих організмів, можна синтезувати з простих неорганічних речовин. Це було дуже важливим і надавало впевненості дослідникам. Завдяки численним дослідам вчені змогли виділяти з організмів все складніші й складніші речовини, встановлювати їх будову. Дослідження живого виявилося багатим на відкриття. Але водночас проблема була настільки складною, що на межі двох наук - органічної хімії і біології - виник цілий ряд нових дисциплін - хімія природних сполук або біохімія, трохи пізніше - генетика, молекулярна біологія тощо. Предметом вивчення кожної з цих наук була окрема ділянка живого на просторовому полі вивчення живих тіл. Виникла потреба пояснити накопичені факти, оцінити їх значення, відібравши з кожної області знань основне. Так виникла біологічна хімія - наука, що вивчає будову та взаємодію в живому організмі найважливіших його складових речовин. Вона є хімічним фундаментом біологічних наук.
Біохімія – це наука, яка вивчає склад, будову, властивості речовин живої природи, а також їх перетворення в процесі життєдіяльності живих об'єктів з метою пізнання молекулярних основ життя. Отже, біохімія вивчає як хімічну природу речовин, з яких побудований живий організм, так і те перетворення залежно від діяльності органів і тканин.
Живий організм нерозривно пов'язаний з навколишнім середовищем, з якого він одержує необхідні для життя харчові речовини, воду та кисень. З цих речовин в організмі утворюються складні біоорганічні сполуки, які безпосередньо беруть участь у біохімічних перетвореннях, унаслідок яких у зовнішнє середовище виділяються продукти розпаду.
Біохімія вивчає не тільки процеси синтезу і розпаду складних органічних сполук у живому організмі, але й те, як ці перетворення пов'язані з поглинанням І виділенням енергії, а також механізми енергетичного обміну, що забезпечують здійснення різних фізіологічних функцій.
Предметом дослідження біологічної хімії є таємниця життя - спосіб існування організмів у земних умовах: білків, нуклеїнових кислот, вуглеводів, ліпідів, їх комплексних сполук, а також низькомолекулярних біорегуляторів білкової і небілкової природи.
Об'єктами вивчення біохімії є живі організми на різних етапах еволюційного розвитку: віруси, бактерії, рослини, тварини, організми людини як біологічний об'єкт.
Тобто, в залежності від об'єкту дослідження біохімію підрозділяють на біохімію тварин, біохімію рослин, біохімію людини і т.д.
Не дивлячись на біохімічну єдність всього живого, в тваринних та рослинних організмах існують значні відмінності, перш за все у характері обміну речовин.
Обмін речовин - це сукупність всіх хімічних реакцій в організмі, що направлені на збереження живих систем.
Рослини будують складні речовини свого тіла (білки, жири, вуглеводи) з таких простих речовин, як карбон (IV) оксид, вода і мінеральні речовини, причому енергія, яка необхідна для цієї синтетичної діяльності, поглинається за рахунок сонячних променів → (фотосинтез) → автотрофи.
Навпаки, тваринні організми потребують у харчуванні не тільки воду та мінеральні компоненти, але й складні сполуки органічної природи (білки, жири, вуглеводи). У тварин прояв життєдіяльності і синтез речовин, що входять до складу тіла, забезпечуються за рахунок хімічної енергії, яка виділяється при розпаді чи окисненні складних органічних сполук → (хемосинтез) → гетеротрофи (потребують доставки речовин орг. природи).
Основні розділи біохімії:
1. Статична біохімія (вивчає склад живих організмів та структуру біомолекул, що входять до їх складу: білків, амінокислот, нуклеїнових кислот, вуглеводів, вітамінів, гормонів тощо).
Сучасна статистична біохімія близька до біоорганічної хімії. На відміну, від біоорганічної хімії, біохімія приділяє основну увагу значенню певних біомолекул в утворенні клітинних та тканинних структур, реалізації фізіологічних функцій організму.
2. Динамічна біохімія (вивчає хімічні, біохімічні реакції, що складають обмін речовин живих організмів). Головними своїми завданнями динамічна біохімія має вивчення перебігу та механізмів реакцій обміну речовин, зокрема перетворень в живих організмах основних біомолекул. Прості біоорганічні молекули, які утворюються в процесі метаболізму (моносахариди, жирні кислоти, амінокислоти, нуклеотиди, низькомолекулярні карбонові кислоти) носять назву метаболітів.
Біоенергетика - розділ динамічної біохімії, що вивчає закономірності вивільнення, акумуляції та споживання енергії в біологічних системах.
3. Функціональна біохімія (вивчає біохімічні реакції, які лежать в основі певних фізіологічних функцій). Функціональна біохімія близька за своєю сутністю до молекулярної фізіології.
Функціональна біохімія, зокрема, вивчає: біохімічні основи травлення поживних речовин в шлунково-кишковому тракті; біохімічні механізми, що лежать в основі таких процесів, як м'язове скорочення, проведення нервового імпульсу тощо.
4. Медична біохімія (розділ біохімії, який вивчає закономірності обміну речовин та їх порушення в умовах як нормального функціонування людського організму, так і виникнення патологічних процесів, зокрема спричинених дією на організм ушкоджуючи факторів біологічного, хімічного, фізичного походження.
Питання 2. Історія розвитку біологічної хімії
Сучасна біохімія як самостійна наука склалася на межі XIX та XX століть. До цього часу питання, що розглядає нині біохімія, вивчались хімією та фізіологією:
VIII-Х століття - розвиток алхімії в Європі. Поступове накопичення фактичного матеріалу про склад найбільш складних органічних сполук.
ХVІ-ХVІІ століття - праці ятрохіміків (від грец. іаtrоs - лікар).
Одним з представників ятрохімії був лікар Парацельс, який висунув припущення про взаємозв'язок хімії з медициною.
XVII століття - ятрохімік І. Ван-Гельмонт вперше припустив, що в «соках» живого тіла є особливі речовини «ферменти», які беруть участь в різноманітних хімічних перетвореннях.
ХVII-ХVIII століття - теорія горючого початку флогістону (пояснення процесів горіння виділенням з тіла особливої невагомої речовини). Спростування цієї теорії пов'язано з працями М.В. Ломоносова та А. Лавуазьє, які відкрили в науці закон збереження матерії (маси). Крім того, Лавуазьє показав, що при диханні, як і при горінні органічних речовин, поглинається кисень і виділяється вуглекислий газ.
Середина ХIX століття - виділення великої кількості нових органічних речовин рослинного і тваринного походження. Початок вивчення ферментів травних соків.
Середина XIX століття - описані ферменти амілаза, пепсин, трипсин.
1839 рік - Лібіх з'ясував, що до складу їжі входять білки, жири та вуглеводи.
1828 рік - синтез мочевини (Б. Велер).
1844 рік - синтез оцтової кислоти (Кольбе).
рік - синтез жирів (Бертло).
рік- синтез вуглеводів (А.М. Бутлеров).
1897 рік - доведена здатність без клітинного дріжджового соку викликати алкогольне бродіння.
XX століття - розквіт біохімії.
Питання 3. Методи біохімічних досліджень
До арсеналу методів дослідження біохімії належать методи органічної хімії та біології, куди входить ряд фізичних та фізико-хімічних методів.
Методи очищення речовин:
Фільтрування (використовують для відділення розчинних речовин від нерозчинних).
Перегонка (заснована на різних температурах кипіння речовин суміші).
Возгонка (перехід речовини з твердого стану, через рідкий, у газоподібний).
Сублімація (перехід речовини з газоподібного стану, через рідкий, у твердий).
Перекристалізація (в основі методу лежить різна розчинність основної речовини і домішки). Необхідно, щоб основної речовини було багато, а домішок - мало. Тоді, по відношенню до основної речовини розчин буде насиченим (частини речовини залишається в осаді), а по відношенню домішок «ненасиченим» (всі домішки залишаться в розчині).
Центрифугування застосовують для відділення рідин від твердих тіл.
Методи виділення речовини:
Екстракція. Цей метод базує на спорідненості речовин до різних за полярністю розчинників. Завжди беруть два розчинники, що не змішуються: воду і гексан, воду і етилацетат тощо. Під час струшування суміші речовин і двох таких розчинників більш полярні речовини концентруються у водній фазі, а менш полярні - у фазі іншого розчинника. Для розділення речовин після струшування відокремлюють шари розчинника один від одного в ділильній лійці.
Висолювання. Цей метод оснований на здатності речовин виділятись із водних розчинів при введенні туди деяких розчинників, найчастіше етилового спирту або ацетону. Інколи висолювання проводять іншим способом: до водного розчину добавляють неорганічну сіль, наприклад амоній сульфат.
Центрифугування. Цей метод оснований на розділенні речовин, які мають різну молекулярну масу, під впливом відцентрової сили, що створюється при обертанні зразка. Прикладом застосування такого методу є розділення дерев'яних та залізних ошурок у воді. Тільки в цьому випадку розділення відбувається під впливом відносно слабкої сили земного тяжіння. І в центрифугах внаслідок швидкого обертання пробірок зі зразками розділення відбувається під дією сил, що в сотні тисяч разів перевищують силу земного тяжіння. Особливо ефективним є центрифугування із застосуванням водних розчинів, густина яких у пробірці зменшується знизу доверху (так зване центрифугування у градієнті густини).
Питання 4. Місце біологічної хімії в системі наук
Біохімія поряд з іншими науками (молекулярною біологією, фізіологією, морфологією, вірусологією, екологією, генетикою, медициною, органічною та неорганічною хімією) надає можливість заглибитись у пізнання тих явищ, які у взаємодії зумовлюють життя. Нині відомо як і чому скорочуються м'язи, як передаються нервові імпульси, як здійснюється процес зору, відчуття смаку та Інше. Проте ще залишилось багато загадок і таємниць у такому складному об'єкті як живий організм.
Досягнення біохімії, порівняно молодої науки вже давно використовуються в промисловості. Вітаміни, гормони, харчові добавки, лікарські препарати широко виробляються на підприємствах.
ЛЕКЦІЯ 2
ТЕМА. ХІМІЯ БІЛКІВ: ВИЗНАЧЕННЯ ТА ФУНКЦІЇ БІЛКІВ
План
Визначення білків.
Амінокислотний склад білків, їх загальні властивості.
Функції білків.
Мета: розглянути амінокислотний склад , біохімічні властивості , просторову будову та функції білків у живих організмах, розвивати вміння прогнозувати властивості макромолекул на основі їх будови, формувати пізнавальний інтерес до майбутньої професії та світоглядні ідеї у студентів.
Література
Губський Ю.І. Біологічна хімія: Підручник. – Київ-Тернопіль: Укрмедкнига, 2000.- С. 18-36.
Мардашко А. А., Миронович Л. М., Степанов Г. Ф.Биологическая и биоорганическая химия: Учебное пособие - К.: - К.: Каравелла,2008. - С. 10 -14
3. Івоненко О.Ф., Яковенко Б.В. Біохімія: Підручник для студентів спеціальності «Фізична культура» педагогічних університетів. - Суми: ВТД «Університетська книга», 2002. - С. 30-68.
4. Астахов А.И., Касьяненко А.И. Химия. - 5-е изд. перераб. - К.: Вища шк. Головное изд-во, 1988. - С. 245-249.
5.Березов Т.Т., Коровин Б.Ф. Биологическая химия: Учебник / Под
ред. С.С.Дебова.-М.: Медицина, 1983. - С. 10-14.
6. Гурецкая В.Л. Органическая химия: Учебник для техникумов сов. торг, и обществ. питання / Под ред. Х.В. Больяна. - 2-е изд., перераб. и доп. - М.: Высшая шк., 1983. - С. 230-244.
7. Цветков Л.А. Органическая химия: Учебник для 10 кл. сред. шк. - 25-е изд., перераб. - М.: Просвещение, 1988. - С. 177-185.
Питання 1. Визначення білків
Серед органічних сполук, що входять до складу клітини, перше місце займають білки. Вони становлять у середньому 18-21% загальної сирої маси організму людини і до 50% його сухої маси.
Білки - це високомолекулярні органічні нітрогеновмісні сполуки, молекули яких побудовані із залишків амінокислот, об'єднаних кислотоамідними (пептидними) зв'язками (-СО-NН-).
Окрім Нітрогену, до складу всіх білків входять атоми Карбону, Оксисену, Гідрогену, а також Сульфуру. Деякі білки містять атоми Феруму, Купруму, Фосфору, Цинку. Молекулярна маса білків коливається в широких межах - від кількох тисяч до сотень мільйонів. Так, молекулярна маса міоглобіну м'язової тканини становить 169000, у той час як білок вірусів грипу має молекулярну масу 332 млн.
Білки є найбільш розповсюдженими з усіх класів біомолекул; вони входять до складу всіх клітинних компонентів мікроорганізмів, рослин, тварин (ядра, біомембран, цитоплазми) та міжклітинних структур. Білковий склад живих клітин ускладнюється пропорційно ступеню складності геному та етапу еволюційного розвитку організму. Кількість різних білків в прокаріотичній клітині Е. Соli - близько 3000, в організмі, що складають біосферу Землі - 1010-1012 різних білків.
Питання 2. Амінокислотний склад білків, їх загальні властивості
Молекулярна маса білків. Бiлки є високомолекулярними сполуками; їх молекулярна маса (м. м.) коливається в межах від декількох тисяч до декількох мільйонів а. о. м. (дальтонів). Індивідуальні білки побудовані з декількох сотень амінокислотних залишків.
Білки можуть складатися з одного або декількох окремих поліпептидних ланцюгів, що об'єднані ковалентними та нековалентними зв'язками. Білки, в яких є один поліпептидний ланцюг, мають молекулярну масу від 5-6 до 50 кДж; білки з більшою м. м. складаються, як правило, з декількох поліпептидних ланцюгів, що складають протомери (субодиниці) - мультиланцюгові білки.
Пептиди - (олігопептиди, поліпептиди) відрізняються від власне білків молекулярною масою (меншою 5-6 кДж) та відповідними фізико-хімічними властивостями.
Форма білкових молекул. Поліпептидні ланцюги, що лежать в основі білкових молекул здатні до формування впорядкованих конформацій (характерних просторових структур). Високовпорядковані конформації створюють певні рівні структурної організації білків (первинна, вторинна, третинна, четвертинна структура білків), що відображуються в різних формах будови білкових молекул.
За формою молекул білки поділяються на глобулярні - кулеподібні (сферичні) та фібрилярні — з витягнутою формою молекули.
Амінокислотний склад білків. У результаті досліджень, проведених на початку XIX ст., було встановлено, що білки, які мають велику молекулярну масу при кислотному гідролізі розпадаються на більш прості, низькомолекулярні органічні сполуки - амінокислоти, які відрізняються одна від одної за своєю будовою. На цей час відомо понад 150 амінокислот.
Проте при гідролізі природних білків вивільнюється 20 різних амінокислот, розміщення кожної з яких у поліпептидному ланцюгу кодується триплетом нуклеотидів у ДНК геному. Амінокислоти, що входять до складу природних білків (протеїногенні амінокислоти), мають загальну хімічну структуру, яка може бути представлена представлена звичайною та проекційною формулами .
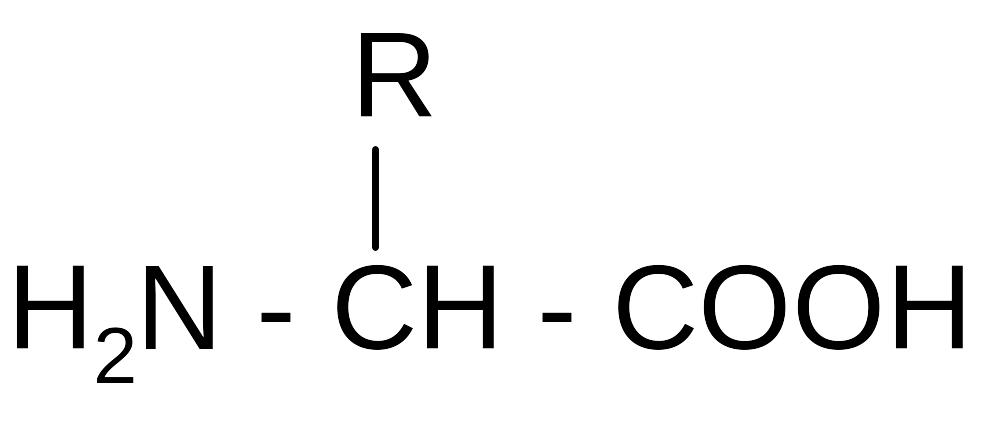
- R - радикал;
- NН2 - аміногрупа;
- СООН - карбоксильна група.
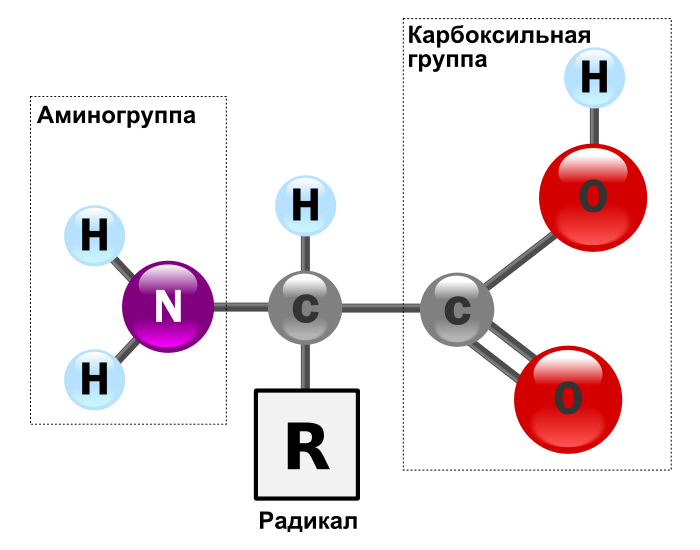
Амінокислоти самі по собі не мають ні тієї біологічної активності, ні токсичності, яка властива білкам. Специфічні функції білкам надає просторова конфігурація, яка, в свою чергу, обумовлена певною послідовністю амінокислот у білковій молекулі.
Амінокислоти, виділені з білків, являють собою похідні насичених карбонових кислот, у яких один або два атоми водню в радикалі заміщені аміногрупою. Як правило, аміногрупою заміщується атом водню біля атома вуглецю, розташованого поруч з карбоксильною групою (а-вуглецевого атома). Якщо в молекулі карбонової кислоти аміногрупами заміщується два атоми водню, то одна з них приєднується до а-вуглецевого атома, а інший - до останнього.
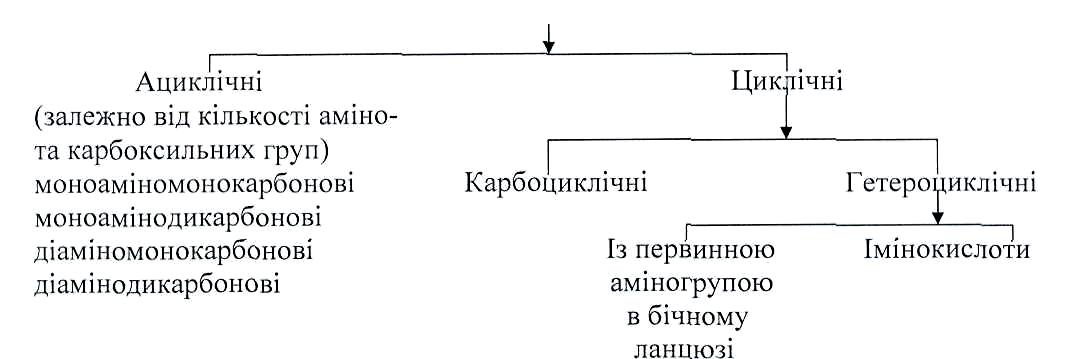
Класифікація прогеїногенних амінокислот.
Природні а-амінокислоти можуть поділятися на класи залежно від хімічної будови бічного радикалу R:
А
 мінокислоти
мінокислоти
Карбоциклічні амінокислоти - цикл яких складається тільки з атомів Карбону. Гетероциклічні - до циклу яких входить це гетероатом, частіше усього Нітроген.
Усі амінокислоти - безбарвні кристалічні речовини, гіркі (крім гліцину) на смак. Більшість амінокислот добре (за винятком сульфуровмісних) розчиняються у воді, мають високу температуру плавлення (220-315°С) і належать до L-ряду. Амінокислоти D-ряду виявлені останнім часом лише в складі мікроорганізмів і антибіотиків.
Таблиця1. Класифікація амінокислот за полярністю радикалу
