
- •Глава 1. Некоронарогенные болезни
- •I II. Стандарты и критерии диагностики воспалительных поражений сердца
- •Глава 2. Функциональные болезни сердца
- •(Заполняется врачом)
- •Глава 3. Метаболические и дегенеративные (дистрофические)
- •Глава 4. Перикардиты
- •Глава 5. Эндокардиты
- •Глава 6. Миокардиты
- •Глава 7. Пролапс митрального клапана
- •Глава 8. Приобретенные пороки сердца
- •Глава 9. Врожденные пороки сердца
- •Глава 10. Дилатационная кардиомиопатия
- •Глава 11. Гипертрофическая кардиомиопатия
- •Глава 12. Рестриктивная кардиомиопатия
- •Глава 13. Аритмогенная кардиомиопатия (дисплазия) правого желудочка
- •Глава 14. Опухоли сердца
- •Глава 15. Травмы сердца
Глава 10. Дилатационная кардиомиопатия
Впервые термин «кардиомиопатия» был предложен W. Brigden в 1957 г. для определения заболеваний сердца неизвестного происхождения. Дилатационная кардиомиопатия характеризуется резким расширением полостей сердца, снижением сократительной функции сердца и развитием сердечной недостаточности. Об истинной распространенности дилатационной кардиомиопатии судить трудно, поскольку частота ее выявления в различных регионах неодинакова. Мужчины болеют в среднем в 3 раза чаще, чем женщины.
Этиология дилатационной кардиомиопатии окончательно не установлена. В настоящее время обсуждается несколько причин иди предрасполагающих факторов развития заболевания, среди которых могут иметь значение вирусные инфекции, беременность и роды, токсические факторы, наследственная предрасположенность. У 40% больных заболевание развивается без каких-либо видимых причин.
В последнее время накапливается все больше доказательств существования генетической предрасположенности к развитию заболевания. Приблизительно у 20-40% больных с дилатационной кардиомио-патией в семейном анамнезе имеются указания на это заболевание. Описана так называемая семейная кардиомиопатия (Evans J.H., 1949), повторившаяся в трех поколениях, установлен аутосомно-доминант-ный тип наследования.
Известен так называемый синдром Барта (Barth) — редкое и сравнительно мало известное генетически обусловленное заболевание сердца, которое приводит к развитию дилатационной кардиомиопатии. Клинические признаки кардиомиопатии появляются у детей мужского пола сразу после рождения или в течение первых месяцев жизни, хотя заболевание диагностируется позднее. Поражение сердца, как правило, сочетается с изменениями скелетных мышц, низким ростом и повышением вероятности возникновения бактериальных инфекций. Отмечается также нейтропения, обнаруживаются нарушения в митохондриях.
325
Некоронарогенные болезни сердца
У больных с дилатационной кардиомиопатией установлена связь со специфическими антигенами системы HLA, у них чаще всего обнаруживают гаплотипы HLA В27, HLA А2, HLA DQ4 и HLA DR4, что указывает на наследственную предрасположенность к заболеванию и свидетельствует о возможной его иммунной основе.
Результаты исследования CARDIGENE (1999) показали, что при дилатационной кардиомиопатии имеют значение генетические нарушения путей эндотелина и полиморфизм гена эндотелиновых рецепторов типа А — первый идентифицированный мощный генетический фактор риска развития заболевания.
Возникновение дилатационной кардиомиопатии связывают с вариантами мутаций гена белка кардиомиоцитов актина, важное значение также отводится патологии гена белка дистрофина, входящего в состав комплекса, связывающего мышечный цитоскелет кардиомиоцита с экстрацеллюлярным матриксом.
Многие исследователи придерживаются полиэтиологической гипотезы происхождения заболевания — описано достаточно случаев развития дилатационной кардиомиопатии, являющейся конечным результатом различных патологических процессов.
Существует вирусно-иммунологическая теория возникновения дилатационной кардиомиопатии. Известно, что вирусы могут поражать сердце здорового человека, иногда бессимптомно, иногда манифестируя умеренно или тяжело протекающим вирусным миокардитом. Реакции на внедрение вируса в сердце, приводящие к дилатационной кардиомиопатии, могут быть различными:
тяжелое поражение сердца во время исходной инвазии,
развитие аутоиммунного процесса после исчезновения вируса,
наличие иммунодефицита усугубляет действие вируса.
После перенесенной инфекции (субклинически протекающего вирусного миокардита) иммунная система организма начинает повреждать собственные ткани (развиваются аутоиммунные повреждения). Вероятно, при возникновении миокардита может «запускаться» цепь аутоиммунных реакций, что приводит к дальнейшему повреждению миокарда и в конце концов к развитию дилатационной кардиомиопатии. Наличие наруше-
326
Некоронарогенные болезни сердца
ний иммунной регуляции и множества антимиокардиальных антител при яилатационной кардиомиопатии согласуется с этой гипотезой: при иммунологическом исследовании повышение титров антител к вирусу Кокса-ки ВЗ обнаруживалось у 40% больных с дилатационной кардиомиопатией и только у 2% в группе здоровых лиц, при этом в эндомиокардиальных биоптатах не обнаруживались признаки миокардита. Несмотря на выявление нарушений гуморального иммунитета, в целом вирусно-инфек-ционно-аутоиммунная гипотеза на сегодня остается недоказанной.
Патологоанатомическая картина характеризуется резкой дилатаци-ей всех полостей сердца. Стенка левого желудочка обычно не утолщена, так как дилатация часто маскирует небольшую степень гипертрофии. Общая масса сердца увеличена и может достигать 1000 г и более. Практически всегда обнаруживаются неспецифическое умеренное равномерное утолщение эндокарда левого желудочка, множественные очаги фиброза. В полостях предсердий и желудочков часто (при вскрытии свыше 50%) обнаруживаются пристеночные тромбы. Атриовен-трикулярное отверстие значительно растянуто, створки клапанов слегка белесоваты, удлинены, как и сухожильные нити. Сосочковые мышцы гипертрофированы, но часто резко склерозированы.
Микроскопически специфических изменений нет, обнаруживаются неравномерная гипертрофия кардиомиоцитов с большими неправильной формы ядрами, также заметна очаговая жировая дистрофия мышечных волокон, дезорганизация миофибрилл, потеря миофиламентов, миоцитолиз, коллапс стромы, интерстициальный фиброз. Отмечаются выраженные дегенеративные и некробиотические изменения кардиомиоцитов (исчезновение поперечной исчерченности, вакуолизация ядер, некроз, умеренное содержание гликогена). Нередко обнаруживаются воспалительные инфильтраты. Следует отметить, что даже при аутопсии возникают затруднения в установлении существа обнаруживаемых при секции изменений. Для дифференциальной диагностики предложен количественный метод подсчета лимфоцитов: при гистологическом исследовании биоптатов миокарда у здоровых лиц и при дилатационной кардиомиопатии в интерстициальной ткани миокарда насчитывается от 5 до 10 лимфоцитов при увеличении в 400 или 200 раз соответственно.
3 27
Некоронарогенные болезни сердца
Превышение этого количества в среднем на 20 в поле зрения при просмотре нескольких препаратов, полученных из различных отделов желудочков, свидетельствует о наличии миокардита.
Не всегда гистологические находки помогают преодолеть диагностические трудности. Е.Н. Амосоваи соавторы (1988) отмечают такие пато-гистологические признаки дилатационной кардиомиопатии:
• распространенная, свыше 30% площади среза, необратимая аль терация кардиомиоцитов с замещением склеротической тканью при минимальной компенсаторной гипертрофии и отсутствии активной воспалительной реакции,
•атрофия свыше 50% жизнеспособных клеток сократительного миокарда,
полиморфизм и аморфность ядер клеток миокарда с индукцией образования в них ядрышкового аппарата,
кальцификация матрикса митохондрий,
разрывы нексусов.
Патогенез. В основе развития дилатационной кардиомиопатии лежит обусловленное повреждением кардиомиоцитов снижение сократительной способности сердечной мышцы. При дилатационной кардиомиопатии выявлен ряд нарушений иммунной регуляции, включая гуморальную и клеточную аутоиммунную реактивность по отношению к миоцитам, снижение содержания и клеточной активности естественных киллеров и отклонения в деятельности супрессорных клеток. Причиной угнетения активности естественных киллеров может служить первичное нарушение их созревания, детерминированное антигенами системы HLA. Угнетение функции Т-супрессоров приводит к развитию аутоиммунных реакций и вторичному цитотоксическому воздействию на миокард специфических антител и иммунных комплексов. При дилатационной кардиомиопатии обнаружены антитела к миокарду у 50% больных, антиинтерфибрилляр-ные антитела — у 49% больных, сенсибилизация к сердечному антигену — у 30% больных. Активация аутоиммунных процессов приводит к образованию антител к миозину и β1-адренорецепторам.
Патогенез дилатационной кардиомиопатии следует прежде всего рассматривать на молекулярном уровне, поскольку нарушается экс-
3 28
Некоронарогенные болезни сердца
прессия генов, приводящая к изменению фенотипа. Выделяют 3 механизма, лежащих в основе развития заболевания:
одиночный генный дефект (дефект дистрофина при семейной ди латационной кардиомиопатии, дефекты кардиального актина кардиоми оцитов при некоторых аутосомно-доминантных вариантах заболевания);
полиморфные изменения генов-модификаторов (в гене АПФ и других компонентах ренин-ангиотензиновой системы и β2-адренерги- ческих рецепторах);
нарушение экспрессии нормальных генов, кодирующих белки, которые регулируют сократительную функцию сердца или формиру ют структуру его полостей.
Функционирование кардиомиоцитов зависит как от механизмов, ответственных за сократимость и расслабление сердца при отсутствии каких-либо внешних воздействий, так и от структур, которые позволяют сердцу быстро повышать или снижать свою активность в ответ на различные физические и психоэмоциональные стимулы. Функционирование сердца во многом определяется эндогенными биоактивными веществами — нейротрансмиттерами, цитокинами, аутокринными и паракринными субстанциями, гормонами.
Клеточные реакции иммуного ответа сопровождаются высвобождением различных цитокинов — интерферона, фактора некроза опухоли, интерлейкина-1, интерлейкина-2 и интерлейкина-6, которые запускают воспалительные реакции и ведут к прогрессирующему поражению миокарда.
Функцией сердца является ритмическое нагнетание крови, притекающей из вен в артериальную систему.
В основе насосной функции сердца лежат важнейшие свойства сердечной мышцы:
возбудимость— способность отвечать возбуждением на раздражение,
проводимость — способность к распространению потенциала дей ствия,
сократимость— способность реагировать механическим, сократитель ным актом в ответ на пришедшую в миокард волну возбуждения,
автоматизм— способность определенных клеток к генерации рас пространяющегося потенциала действия, это свойство имеет ритми ческий характер.
329
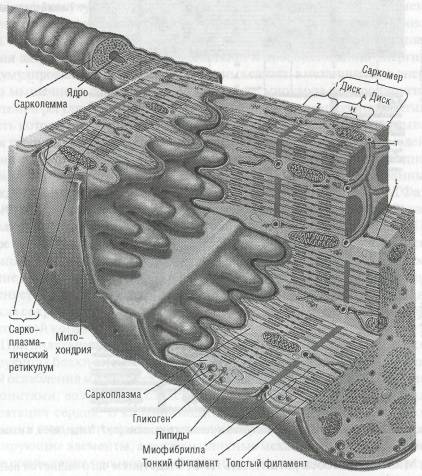
Левый желудочек уникален по своей структуре: ориентация волокон имеет строго упорядоченное непрерывное распределение. Субэн-докардиальные (наиболее глубоколежащие) волокна идут преимущественно продольно от фиброзной области вокруг клапанов (основание сердца) к другому концу приблизительно эллипсоидной камеры (верхушке); чуть более удаленные волокна лежат под небольшим углом к оси камеры и к верхушке идут как бы по спирали. Для волокон более глубоких слоев угол постепенно увеличивается, так что приблизительно на середине стенки они проходят параллельно наименьшей оси камеры, то есть по окружности. Затем угол продолжает увеличиваться, и волокна наружной поверхности стенки желудочков (эпикардиальные) снова идут продольно. Такое расположение позволяет желудочку развивать значительные усилия, несмотря на то что по отдельности мышечные волокна могут выдерживать только аксиальную нагрузку.
Сократительный аппарат мышечных волокон сердца состоит из продольно ориентированных миофибрилл, которые образованы последовательно соединенными саркомерами, являющимися основной структурной и функциональной единицей миокарда (рис. 44). Саркоплазма миофибрилл содержит центрально расположенное ядро, большое число митохондрий, служащих основным источником энергообразования, и саркоплазматический ретикулум, являющийся структурной основой сопряжения возбуждения и сокращения.
Своей способностью развивать усилие и укорачиваться мышца обязана структуре саркомера, длина которого строго пропорциональна длине мышцы (рис. 45). В саркомере различают диски, актиновые и миозиновые нити, тропомиозин, тропониновые комплексы. Границей между двумя саркомерами является диск Z, от которого отходят тонкие нити актина. Область диска А (внутри саркомера) состоит из толстых нитей миозина. В зоне Н диска А нити актина прерываются, и она представлена только нитями миозина. Часть саркомера между концами миозиновых нитей составляет диск I, который состоит только из тонких нитей актина. Организация сократительных белков в миофиб-риллах служит основой механизма мышечного сокращения.
330
Некоронарогенные болезни сердца
Рис. 44. Схема структуры мышцы сердца (по F. Netter, 1969, с изменениями)
Некоронарогенные
болезни сердца
Миозин способен расщеплять АТФ, следствием чего является выделение энергии для сокращения, а также обратимо связываться с актином в актомиозиновый комплекс, что проявляется сокращением мио-фибрилл. Ферментативные свойства миозина и способность его связываться с актином активируются Са++. В состоянии покоя Са++ находится
332
Некоронарогенные болезни сердца
в связанном состоянии в цистернах саркоплазматического ретикулума. Побуждающий СТИМул, распространяясь по канальцам саркоплазмати-ческого ретикулума, способствует открытию L-типа Са-каналов мем-баны, черезкоторыевклеткупоступаютионыСа++,акгивирующиемио-зин В итоге происходит дефосфорилирование АТФ, устранение препятствия актомиозиновому взаимодействию и преобразованию энергии, аккумулированнойвконцевыхфосфатныхсвязях,вмеханическую энергию мышечного сокращения. Сокращение миокарда контролируется системой регуляторных белков - тропонином и тропомиозином, активность которых стимулируется Са++. Освобождаемый кальций связывается тропонином, что снимает тропомиозиновую репрессию взаимодействия актина и миозина (рис. 46). Повышение концентрации свободного внутриклеточного кальция одновременно активирует две связанные между собой ферментные системы: «кальциевый насос» (Na+/K+-АТФазу мембраны) и натриево-кальциевый ионообменный механизм, обеспечивающие удаление ионов кальция из цитоплазмы кардиомиоцита. По мере снижения концентрации свободного внутриклеточного кальция его комплексы с тропонином диссоциируют, тропомиозиновое ингибиро-вание актомиозиновых взаимосвязей восстанавливается, и сокращение сменяется расслаблением. Таким образом, физиологическая регуляция цикла сокращение - расслабление определяется изменениями внутриклеточной концентрации ионов Са++.
При дилатационной кардиомиопатии найдены мутации генов, кодирующих белки внеклеточного матрикса, что может служить причиной ослабления механической взаимосвязи между последним и кардио-миоцитами, возможным следствием чего является прогрессирующая дилатация сердца. В кардиомиоцитах происходят изменения в экспрессии генов, которые затрагивают контрактильные белки или их регулирующие элементы, а также различные механизмы, обеспечивающие сопряжение процессов возбуждения - сокращения, бета-адренер-гические пути проведения и процессы, приводящие к дефициту энергетических механизмов.
Сила сокращения мышечных волокон зависит от их исходной длины (закон Франка - Старлинга), что является решающим фактором,
333
Некоронарогенные
болезни сердца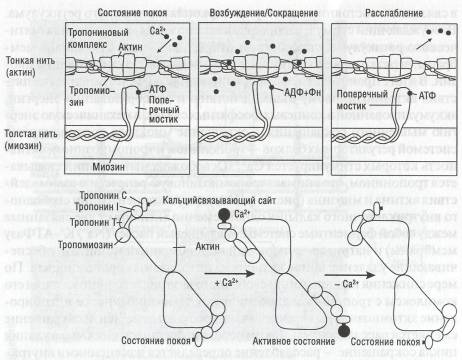
определяющим функцию сердечной мышцы. При фиксированной исходной длине миокардиальных волокон реализуется инотропный механизм, который является детерминантой качественной характеристики процесса мышечного сокращения. Влияя на интенсивность преобразования химической энергии дефосфорилирования АТФ в механическую энергию сокращающейся мышцы на этапе формирования акто-миозиновых контактов, он регулирует и силу, и скорость сокращений миокардиальных волокон, изменяя их сократимость. В условиях положительных инотропных влияний возникает рост мощности миокарда и выполняемой им работы.
Некоронарогенные болезни сердца
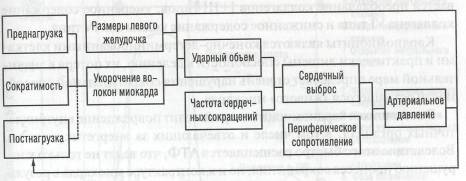
Ударный объем интактного желудочка в конечном счете определяется тремя факторами:
длиной мышцы в начале сокращения — преднагрузкой,
инотропным состоянием мышцы (сократимостью)— состоянием связей сила — скорость — длина,
напряжением, которое должна развивать мышца во время сокра щения, то есть постнагрузкой (схема 4).
Схема 4. Взаимодействие различных компонентов, регулирующих сердечную деятельность
Основным критерием сократительного состояния миокарда служит развиваемое им напряжение — формируемая волокнами сила (во время выброса крови), действие которой направлено на их укорочение, отнесенная к суммарному поперечному сечению миокардиальных волокон. Источником этой силы является энергия, образующаяся в миокарде вследствие окисления и аккумулируемая главным образом в форме АТФ. Напряжение миокарда левого желудочка способствует сокращению стенки желудочка, уменьшению его полости и изгнанию из него крови. Если функция левого желудочка начинает нарушаться, то есть нет резерва преднагрузки, то в поддержании функции сердца значительно возрастает значение постнагрузки левого желудочка.
При дилатационной кардиомиопатии происходит диффузное поражение миокарда с развитием деструкции кардиомиоцитов и формированием заместительного фиброза. Определенная роль в развитии фиб-
335
Некоронарогенные болезни сердца
Некоронарогенные болезни сердца
роза отводится деградации нормального коллагенового матрикса металлопротеиназами, активация которых происходит вследствие активации провоспалительных цитокинов и экспозиции свободных кислородных радикалов (оксидантного стресса). Одновременно происходит аномальный синтез коллагена фибробластами. Вновь образуемые коллагеновые структуры характеризуются извращенным соотношением между типами коллагена и нарушением архитектоники взаиморасположения волокон. При дилатационной кардиомиопатии обнаруживается преобладание коллагенов I+III типов, умеренное содержание коллагена VI типа и сниженное содержание коллагена IV типа.
Кардиомиоциты являются конечно-детерминированными клетками и практически лишены способности к делению, их потеря в значительной мере определяет степень нарушения сократительной способности оставшегося «живого» миокарда.
В оставшихся кардиомиоцитах происходит повреждение внутриклеточных органелл, в том числе и отвечающих за энергетику клетки. Вследствие этого быстро расщепляется АТФ, что ведет не только к нарушению процесса сокращения, но и к контрактуре миокарда в результате нехватки энергии и кальциевой перегрузки. При этом одновременно значительно снижаются показатели как систолы, так и диастолы. Процесс наполнения желудочков характеризуется существенным изменением временных, скоростных и объемных показателей всех фаз диастолы, «вклад» систолы предсердий в наполнение желудочков отсутствует уже на самых ранних этапах декомпенсации. Нарушение систолической функции левого желудочка проявляется в уменьшении максимальной скорости укорочения миокардиальных волокон во время их возбуждения, в снижении скорости нарастания внутрижелудоч-кового давления и достигаемого максимума давления в период напряжения миокарда, в удлинении периода напряжения и укорочении периода изгнания (изменения фазовой структуры систолы) (рис. 47). Увеличение объема остаточной крови приводит к постепенному расширению полости левого желудочка.
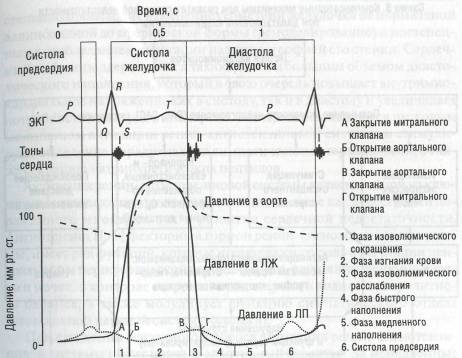
Рис. 47. Схематическое изображение сердечного цикла
При повреждении миокарда и дилатации сердца происходит активация различных компенсаторных механизмов, направленных на нормализацию сердечной деятельности (схема 5).
Благодаря системе нейрогуморальной регуляции сердце в течение определенного периода способно поддерживать насосную функцию при сниженной сократительной способности миокарда с помощью срочных механизмов компенсации гемодинамики, к которым относятся активация механизма Франка — Старлинга и повышение хроно- и инотропной активации миокарда.
Долговременные компенсаторные механизмы включают развитие гипертрофии оставшихся жизнеспособных кардиомиоцитов и измене-
Некоронарогенные болезни сердца
Схема 5. Компенсаторные механизмы при развитии сердечной недостаточности при дилатационной кардиомиопатии
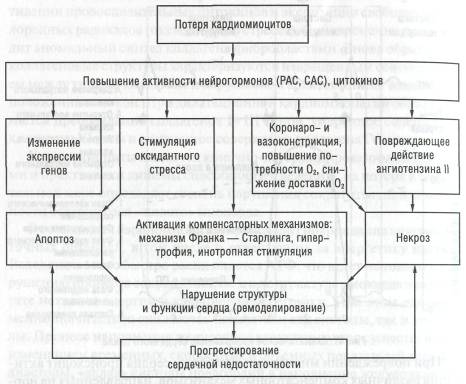
ние геометрии камер сердца, что составляет суть ремоделирования левого желудочка. Дилатация желудочка служит ранним компенсаторным ответом на уменьшение сократимости и кинетики стенок, способствуя сохранению полноценного ударного объема за счет увеличения конечного диастолического объема.
Гипертрофия миокарда у больных с дилатационной кардиомиопа-тией не достигает адекватной степени и не отвечает нуждам дилатиро-ванного сердца, поскольку сократительная активность гипертрофированного миокарда на единицу массы ниже, чем в здоровом сердце. По-
Некоронарогенные болезни сердца
степенно происходит изменение геометрии желудочка от нормальной эллипсоидной до сферической формы (ремоделирование) и постепенным преобладанием дилатации над гипертрофией его стенки. Сердечный выброс поддерживается тахикардией и большим объемом диастолического наполнения, который в свою очередь повышает внутримио-кардиальное напряжение как в систолу, так и в диастолу и увеличивает потребность миокарда в кислороде. Эти процессы являются пусковым механизмом активации ренин-ангиотензиновой системы и стимулируют выделение норадреналина симпатическими терминалями, а также секрецию натрийуретических пептидов.
Активация ренин-ангиотензиновой системы является одной из ключевых составляющих процессов, лежащих в основе как перестройки пораженного миокарда, так и развития сердечной недостаточности. Ангиотензин II, эффекторный гормон ренин-ангиотензиновой системы, имеет ряд функций, которые играют важную роль в регуляции центральной и периферической гемодинамики, регуляции функции сердца и почек, в контроле секреции альдостерона и водно-электролитного баланса, а также модулирует функцию симпатического отдела вегетативной нервной системы (схема 6).
При снижении сердечного выброса активация ренин-ангиотензиновой системы носит вначале адаптивный характер. За немедленные реакции (вазоконстрикцию, задержку натрия и воды, инотропную и хронотропную реакции) ответственна циркулирующая система, за хронические реакции (митогенное усиление роста клеток, гипертрофию, апоптоз) ответственна тканевая система, находящаяся непосредственно в миокарде.
Длительная чрезмерная активация ренин-ангиотензиновой системы оказывает повреждающее действие, следствием чего является:
потенцирование активности других нейрогормональных систем — симпатоадреналовой, эндотелина, также играющих важную роль в раз витии апоптоза и некроза, клеточного роста и ремоделирования;
сосудистые эффекты — коронарная и системная вазоконстрикция, провоцирующие увеличение нагрузки на сердце и потребность мио карда в кислороде, что в комбинации с задержкой жидкости ведет к
339
мнявмвм
Некоронарогенные болезни сердца
Схема 6. Регуляторные зффекты ангиотензина II в условиях сниженного сердечного выброса
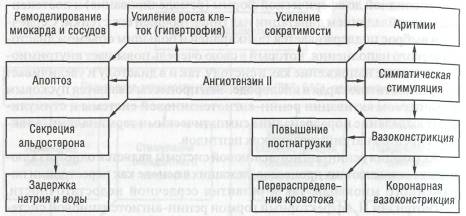
гемодинамической перегрузке и перерастяжению стенки пораженного миокарда и служит пусковым моментом к развитию апоптоза, изменению генной экспрессии и ремоделирования;
• непосредственное токсическое повреждающее действие ангиотензина II на кардиомиоциты, что приводит к их дисфункции и гибели.
Ангиотензин II является самостоятельным триггерным фактором реакций генетического ответа и клеточного роста, что вызывает гипертрофию кардиомиоцитов и гиперплазию фибробластов (развитие фиброза). Вследствие развития фиброза происходит уменьшение плотности капилляров миокарда, приводящее к его ишемизации.
Активация симпатоадреналовой системы у больных с дилатацион-ной кардиомиопатией носит вначале компенсаторный характер, обеспечивая насосную функцию сердца путем повышения частоты сокращений сердца и сократимости миокарда, поддержания артериального давления в условиях сниженного сердечного выброса, вызывая кон-стрикцию артериол, потенцируя веноконстрикцию, обеспечивая венозный возврат и повышение давления наполнения сердца и сердечный выброс посредством механизма Франка — Старлинга. В дальнейшем симпатическая активация играет важную роль в прогрессировании сердечной недостаточности (схема 7).
Некоронарогенные болезни сердца
Схема 7. Роль симпатоадреналовой системы в патогенезе прогрессирования хронической сердечной недостаточности при дилатационной кардиомиопатии
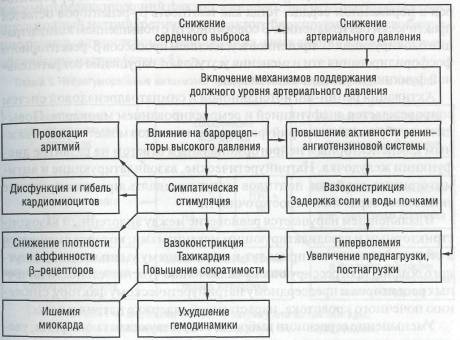
Длительная активация симпатоадреналовой системы оказывает ряд негативных эффектов на сердечно-сосудистую систему, включая повышение потребности в кислороде, депрессию силы сокращения (вследствие увеличения частоты сердечных сокращений), снижение чувствительности β-an-ренорецепторов к катехоламинам, повышение уровня ренина и ангиотензина II, прямое токсическое воздействие на миокард (перегрузка кардиомиоцитов Са++, прогрессирующая гибель клеток миокарда в результате некроза и апоптоза, угнетение функции митохондрий (окислительно-восстановительное напряжение), что опосредуется через β-peцeптopы сердца и цАМф, повышается концентрация катехоламинов в плазме крови.
Описанные изменения подкрепляются нарушениями со стороны β-aдpeнepгичecкиx путей проведения, в значительной мере модулирующих
Некоронарогенные болезни сердца
функцию сердца на рецепторном и клеточном уровнях. В результате происходит значительное уменьшение количества и плотности β1-peцenтo-ров в пораженном сердце, тогда как плотность β2-рецепторов остается практически без изменений. В совокупности с повышением концентрации блокирующих G-протеинов и усилением процессов β-рецепторного фосфорилирования эти изменения усугубляют нарушения сократительной функции пораженного миокарда.
Активация ренин-ангиотензиновой и симпатоадреналовой систем сопровождается дисфункцией и ремоделированием миокарда. Повышенное образование натрийуретических пептидов может служить важным компенсаторным нейрогормональным ответом на развитие дисфункции желудочка. Натрийуретические, вазодилатирующие и анти-митогенные свойства пептидов могут замедлять прогрессирование симптомов сердечной недостаточности.
В дальнейшем нарушается равновесие между эндогенным вазокон-стрикторным и вазодилатирующим механизмами, которое смещается в сторону первых, что приводит к дальнейшему уменьшению минутного объема, прогрессирующему ослаблению чувствительности почечных рецепторов к предсердному натрийуретическому фактору, снижению почечного кровотока, нарастающей задержке натрия и воды.
Уменьшение сердечного выброса, сопутствующая тахикардия, увеличение экстраваскулярного компонента коронарного сопротивления (повышение конечно-диастолического давления в левом желудочке) приводят к перераспределению коронарного кровотока, обеднению кровоснабжения субэндокардиальных областей. Измененная геометрия желудочков приводит ко вторичной функциональной митральной илитрикуспидальной регургитации и дилатации предсердий.
Среди причин, приводящих к прогрессирующей альтерации цито-архитектоники миокарда и сосудов, избыточному накоплению внеклеточного матрикса, несбалансированной гипертрофии миокарда и сосудистой стенки при дилатационной кардиомиопатии и сердечной недостаточности рассматривается активация «immediate early» — генов, неспецифических факторов роста (вазопрессин, ангиотензин II, эндо-
342
Некоронарогенные болезни сердца
телин, альдостерон, катехоламины и др.), нарушение продукции вазо-депрессорных субстанций (простациклин, оксид азота, эндотелийза-висимый релаксирующий фактор, кинины). Значительную роль играет предсердный натрийуретический фактор, блокирующий высвобождение ренина, альдостерона, вазопрессина, снижающий канальцевую ре-абсорбцию натрия (схема 8).
Схема 8. Нейрогуморальные механизмы прогрессирования сердечной недостаточности
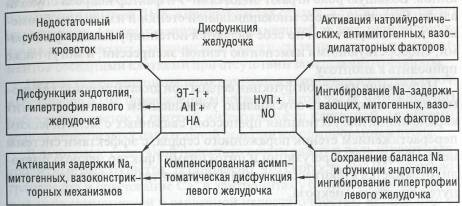
ЭТ-1 — эндотелин-1, НУП — натрийуретические пептиды, АII — ангиотензин II, N0 — оксид азота, НА — норадреналин.
Процесс ремоделирования периферических сосудов и сердца у больных с сердечной недостаточностью протекает параллельно и подчинен единым патофизиологическим механизмам. Повреждение миокарда с ухудшением сократительной деятельности желудочков сердца приводит к увеличению сосудистого сопротивления, снижению податливости стенок сосудов и дисфункции эндотелия. Последняя способствует нарастанию дилатации, зависимой от кровотока, и увеличению перегрузки сердца.
На определенном этапе перестройка гемодинамики начинает отрицательно сказываться на работе сердца вследствие существования обратной зависимости между системным сосудистым сопротивлением и ударным объемом. Создается порочный круг: снижение сердечного
343
Некоронарогенные болезни сердца
выброса приводит к повышению системного сосудистого сопротивления, которое в свою очередь снижает сердечный выброс.
Активация нейрогормонов, цитокинов, перестройка биомеханики миокарда обусловливают изменение генной экспрессии, гибель кар-диомиоцитов, клеточное ремоделирование, что в свою очередь является причиной дисфункции миокарда и его ремоделирования. Возможно, генотип изначально приводит к активации нейрогормонов и цитокинов. Большую роль играют эндотелии-1 и фактор некроза опухоли альфа. Растущий стресс миокардиальной стенки и изменение биомеханики миокарда сами по себе являются потенцирующими факторами, способствующими изменению генной экспрессии, и могут также приводить к апоптозу.
Нарушение насосной функции сердца при дилатационной кардио-миопатии может быть обусловлено уменьшением количества самих кардиомиоцитов. Активация процессов, связанных с механическим перерастяжением стенок пораженного сердца, с эффектами системы нейрогуморальной регуляции и цитокинами (фактор некроза опухоли) отражается в прогрессирующей потере контрактильных элементов путем апоптоза и некроза.
Апоптоз — это процесс физиологической смерти клеток запрограммированным путем, впервые описанный в 1971 г. Кегги соавторами. Апоптоз включает в себя потерю поверхностного контакта с соседними клетками, сморщивание клетки, конденсацию хроматина и фрагментацию хромосомной ДНК. Погибшая клетка подвергается экстра-целлюлярной дегенерации или утилизируется в результате фагоцитоза макрофагами без возникновения признаков воспаления. Апоптоз может быть «запущен» одним из двух путей, опосредованных «смертельными рецепторами» (death-receptors) или «несмертельными рецепторами» (nondeath-receptors). Первые формирует семейство протеинов, которые активируются после присоединения экстрацеллюлярных «запускающих гибель» факторов. Несмертельные рецепторы опосредуют апоптозные сигналы, включающие множество внутриклеточных сигнальных путей, которые обычно включают митохондрии.
344
Некоронарогенные болезни сердца
Среди триггерных факторов апоптоза рассматриваются оксидант-ный стресс, ангиотензин II, фактор некроза опухоли, предсердный на-трийуретический пептид, гипоксия и напряжение стенки. Развитию процессов апоптоза кардиомиоцитов способствуют изменения экспрессии генов р53, Вс1-2, Вах.
Точный механизм гибели клеток неизвестен, однако накапливаются экспериментальные доказательства того, что ангиотензин II является мессенджером развития этих процессов, вызывает дозозависимое повышение синтеза ДНК в фибробластах сердца, а также индуцирует их миграцию. Апоптоз «запускается» активацией эндогенной эндонук-леазы, что приводит к эндонуклеолизису и удалению апоптозных фрагментов соседними клетками при отсутствии замещающего фиброза.
Некроз кардиомиоцитов характеризуется истощением внутриклеточных запасов АТФ, повреждением органелл (в том числе митохондрий), набуханием клеток и потерей интегральности клеточной мембраны, возникновением воспалительной реакции и формированием рубца.
В патогенезе сердечной недостаточности важную роль играют электролитные расстройства. Установлено, что скорость Na+/H+-противо-транспорта и содержание Са+ в эритроцитах у больных с дилатационной кардиомиопатией и сердечной недостаточностью независимо от стадии заболевания достоверно выше, чем у здоровых лиц. Это можно объяснить наличием ионного, в частности, натриевого и кальциевого дисбаланса.
Таким образом, в основе перестройки миокарда вследствие миокар-диального поражения сердца лежат процессы апоптоза, некроза, патологического ремоделирования кардиомиоцитов и сердца, изменения экспрессии генов, коронарная и периферическая вазоконстрикция, нагрузочные условия, что во многом обусловлено нарушением баланса нейрогормональных систем. Основой процессов ремоделирования, приводящих к развитию сердечной недостаточности, являются нарастание гипертрофии, активация образования коллагеновой ткани, компенсаторное увеличение объемов камер сердца. Эти процессы активируются в ответ на повышенный выброс вазоактивных соединений, изменение активности вегетативной нервной системы, увеличение
345
Некоронарогенные болезни сердца
продукции фактора роста и других гуморальных факторов, возникновение относительной недостаточности коронарного кровотока, электролитный дисбаланс.
Клиника. Заболевание обычно имеет хроническое течение, одышка при физической нагрузке и повышенная утомляемость обусловлены высоким диастолическим давлением в левом желудочке. Как правило, ранние стадии выявляют случайно при профилактическом, рентгенологическом или электрокардиографическом исследовании. Период от появления первых симптомов до возникновения развернутой клинической картины заболевания составляет обычно 2 года. Поскольку оба желудочка могут быть вовлечены одинаково, выражены также симптомы недостаточности правого желудочка.
Клинические симптомы дилатационной кардиомиопатии:
1. Выраженная недостаточность кровообращения по левожелудоч- ковомутипу:
быстрая утомляемость, непереносимость физических нагрузок,
одышка,
цианоз,
ортопноэ,
приступы сердечной астмы и отека легких.
2. Выраженная недостаточность кровообращения по правожелудоч- ковомутипу:
•акро цианоз,
набухание шейных вен,
боль в области печени,
увеличение печени,
асцит,
отек нижних конечностей.
3. Тотальная недостаточность кровообращения: •кардиомегалия,
глухость тонов сердца,
ритм галопа,
систолический шум относительной недостаточности митрально го или трехстворчатого клапана,
кахексия.
346
Некоронарогенные болезни сердца
4. Нарушения ритма сердца:
фибрилляция предсердий,
пароксизмальная тахикардия,
экстрасистолическая аритмия,
нарушения проводимости.
В возникновении желудочковых нарушений ритма играет роль ге-модинамический фактор — дисфункция левого желудочка, снижение сократимости, растяжение миокарда, повышение внутрисердечного давления, который обусловливает повышение мембранного автоматизма. Увеличение нагрузки на миокард приводит к повышению амплитуды ранней постдеполяризации, что играет существенную роль в возникновении преждевременных желудочковых сокращений. Растяжение волокон миокарда связано с неспецифическим изменением проницаемости мембран и кальциевого обмена.
5. Тромбоэмболический синдром (тромбы в предсердиях и желудочках, тромбоэмболия легочной, селезеночной, мозговых артерий).
С нарастанием тяжести сердечной недостаточности наблюдается ухудшение показателей реологических свойств крови: в среднем на 30% повышаются предел текучести и вязкость, коэффициент адгезии эритроцитов, а также афегационная способность тромбоцитов. Удлинение времени ретракции и времени образования сгустка при тромбоэлас-тографии свидетельствует о наличии синдрома коагулопатии потребления. Выраженные нарушения в системе гемореологии и микроциркуляции, изменения функциональных свойств эритроцитов и тромбоцитов, усугубляющиеся развитием сердечной недостаточности, можно рассматривать как один из механизмов, способствующих повышенному тромбообразованию.
На ЭКГ могут выявляться:
синусовая тахикардия,
признаки гипертрофии левого или правого желудочка,
признаки гипертрофии левого или правого предсердия,
снижение вольтажа в отведениях от конечностей,
повышение вольтажа в грудных отведениях,
AV-блокада различной степени,
347
Некоронарогенные
болезни сердца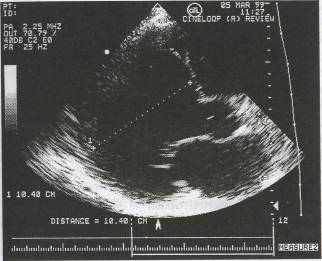
блокада левой ножки пучка Гиса,
уширение желудочкового комплекса с признаками локального на рушения внутрижелудочковой проводимости,
нарушения ритма сердца: экстрасистолия, фибрилляция предсердий,
появление отрицательного зубца Т в прекардиальных отведениях,
появление глубокого зубца Q в прекардиальных отведениях (при знаки крупноочаговых изменений миокарда), что симулирует пе ренесенный инфаркт миокарда,
•иногда недостаточное повышение амплитуды зубца R в грудных отведениях.
Суточное мониторирование ЭКГ часто выявляет тяжелые желудочковые нарушения ритма, не обнаруживаемые при обычной регистрации: потенциально опасные в отношении внезапной смерти спаренные желудочковые экстрасистолы и пароксизмы желудочковой тахикардии.
На фонокардиограмме регистрируются:
снижение амплитуды I тона,
появление патологического III и IVтона,
систолический шум в области верхушки,
систолический шум в области мечевидного отростка. При рентгенологическом исследовании выявляются:
кардиомегалия — увеличение всех камер сердца,
выпуклость дуги левого желудочка,
отсутствие четкой дифференцировки талии,
закругленность верхушки,
диффузное снижение амплитуды кимографических зубцов,
отсутствие атеросклеротического поражения аорты,
• умеренные изменения в малом круге кровообращения, преиму щественно за счет венозного застоя.
Эхокардиография является основным методом диагностики дила-тационной кардиомиопатии, с помощью которой обнаруживаются:
диффузное снижение сократимости, диффузная гипокинезия стенок,
выраженная дилатация камер сердца (рис. 48),
348
Рис. 48. ЭхоКГ у больного с дилатационной кардиомиопатией (В-режим; конечно-диастолический размер =10 см)
преобладание дилатации над гипертрофией (относительное умень шение толщины стенок желудочков),
смещение митрального клапана к верхушке сердца,
увеличение конечно-систолического размера сердца,
увеличение конечно-диастолического размера сердца,
увеличение массы миокарда левого желудочка,
снижение степени укорочения переднезаднего размера левого же лудочка в систолу,
интактные клапаны сердца, снижение амплитуды раскрытия ство рок митрального клапана, нередко дополнительная волна «В» передней створки митрального клапана (вследствие повышения конечно-диастолического давления в левом желудочке),
снижение скорости открытия аортального клапана,
митральная и трикуспидальная регургитация,
внутриполостные тромбы.
349
Некоронарогенные болезни сердца
Данные иммунологических исследований свидетельствуют о достоверном снижении активности естественных киллеров, повышении уровня фактора некроза опухолей по сравнению со здоровыми лицами, а также о наличии специфических циркулирующих антител, которые являются важными маркерами дилатационнои кардиомиопатии:
• антимиозиновые антитела (к а- и β-тяжелым цепям миозина), •антимитохондриальные антитела:
•к М7,
к адениннуклеотидному транслокатору — ферменту внутренней мембраны митохондрий сердца, осуществляющему перенос АТФ и АДФ между цитоплазмой кардиомиоцитов и матриксом этих органелл,
антитела к β-адренорецепторам.
При проведении прижизненной биопсии миокарда обнаруживают неспецифические дистрофические изменения:
дегенеративные различной степени, •миоцитолиз,
очаги некроза.
Как указывалось выше, характерные морфологические признаки дилатационнои кардиомиопатии при гистологическом исследовании отсутствуют. Как правило, выявляются множественные очаги фиброзного замещения миокарда, иногда воспалительные инфильтраты.
Для диагностики используют также радионуклидные методы исследования.
1. При радионуклидной вентрикулографии определяют:
• расширение полостей сердца,
нарушение локальной сократимости на фоне диффузного сниже ния сократимости миокарда,
значительное снижение фракции выброса левого и правого желу дочков.
При сцинтиграфии миокарда с таллием-201 выявляют диффуз ные и очаговые дефекты накопления препарата.
При сцинтиграфии миокарда с галлием-67 изотоп накапливается в воспалительных очагах при миокардите и не накапливается при ди латационнои кардиомиопатии.
350
Некоронарогенные болезни сердца
Катетеризацию сердца проводят, если диагноз остается под сомнением после неинвазивного исследования. Сердечный выброс может быть нормальным или сниженным, но фракция выброса угнетена, и на ангиограмме отмечается диффузный гипокинез. Клапанные градиенты и кальцификация отсутствуют, коронарные артерии не изменены. Повышение конечно-диастолического давления в левом желудочке наблюдается в поздних стадиях заболевания. Во время катетеризации можно произвести биопсию миокарда из каждого желудочка.
Диагноз дилатационнои кардиомиопатии устанавливают методом исключения всех заболеваний, при которых могут наблюдаться увеличение полостей сердца и недостаточность кровообращения: специфические заболевания миокарда, включая алкогольную кардиомиопатию, ИБС, артериальная гипертензия, физиологическое увеличение размеров сердца в период беременности или у спортсменов.
Диагностические критерии дилатационнои кардиомиопатии включают подтверждающие и исключающие признаки. К подтверждающим признакам относят:
Прогрессирующую недостаточность кровообращения, резистент ную к лечению.
Кардиомегалию с наличием относительной недостаточности мит рального и трехстворчатого клапанов.
Тромбоэмболический синдром.
Нарушения ритма, проводимости.
Относительно молодой возраст.
Отсутствие признаков воспалительного процесса.
Отсутствие связи заболевания с инфекционным или каким-либо другим этиологическим фактором.
Исключающие признаки:
нормальные размеры сердца,
ИБС (обструкция более 50% просвета основных коронарных ар терий),
системная артериальная гипертензия (выше 160/100 мм рт. ст.), до кументированная и подтвержденная при повторных измерениях, и/или доказательства поражения органов-мишеней,
~351
Некоронарогенные болезни сердца
отсутствие врожденных пороков сердца и приобретенных изме нений клапанного аппарата сердца,
указания в анамнезе на хроническое употребление алкоголя (бо лее 40 г в день для женщин и более 80 г в день — для мужчин в тече ние свыше 5 лет) с ремиссией дилатационной кардиомиопатии после 6 мес абстиненции,
системные заболевания,
врожденные или приобретенные пороки сердца,
поражения перикарда.
Прогноз при дилатационной кардиомиопатии неблагоприятный. Общая смертность составляет 70% в течение 5 лет, в 50% случаев смерть наступает внезапно, вероятно, вследствие развития злокачественных аритмий. Главным прогностическим признаком является функциональное состояние левого желудочка. В какой-то степени прогностически благоприятными признаками считаются незначительное повышение артериального давления (отсутствие артериальной гипотензии) и наличие выраженной гипертрофии левого желудочка. Прогноз лучше , если реактивная гипертрофия адекватна для сохранения толщины стенки желудочка, и хуже в случае значительного истончения стенок желудочков. Неблагоприятный прогноз связан с несостоятельностью желудочков или частой желудочковой аритмией (большим числом желудочковых экстрасистол IV и более высоких градаций по В. Lown) при 24-часовом мониторировании ЭКГ, а также наличием фибрилляции предсердий. Продолжительность жизни мужчин с данным заболеванием вдвое меньше, чем у женщин.
При фракции выброса менее 20% годичная смертность составляет 30%, а при менее 10% продолжительность жизни — не более 6 мес. Важным прогностическим показателем при дилатационной кардиомиопатии с фракцией выброса менее 30% является отношение содержания норадреналина в плазме крови к его концентрации в миокарде (по данным эндомиокардиальной биопсии).
Факторами риска неблагоприятного прогноза, обусловленного про-грессированием недостаточности кровообращения, могут быть:
• содержание натрия в сыворотке крови < 134 мэкв/л,
Некоронарогенные болезни сердца
диастолическое давление в легочной артерии > 19 мм рт. ст.,
диастолический индекс объема левого желудочка > 44 мм/м2,
пик потребления кислорода во время максимальной физической нагрузки (анаэробный порог) < 11 мл/кг в 1 мин.
При отсутствии этих факторов риска вероятность нарастания недостаточности кровообращения в течение года составляет 2%. Гипонат-риемия или наличие любых двух факторов риска повышает этот показатель до 50% и более.
Лечение сердечной недостаточности при дилатационной кардио-миопатии должно включать несколько кардинальных задач:
предотвращение прогрессирования сердечной недостаточности, ремоделирования сердечно-сосудистой системы (уменьшение ней- роэндокринной, клеточной активации),
уменьшение выраженности симптоматики (улучшение систоли ческой функции сердца, периферического кровообращения),
улучшение качества жизни (улучшение переносимости физичес ких нагрузок),
увеличение продолжительности жизни (улучшение прогноза),
уменьшение числа случаев госпитализации,
уменьшение количества осложнений.
Важное значение в лечении больных с сердечной недостаточностью имеет уменьшение преднагрузки за счет ограничения приема жидкости и соли и постнагрузки путем контроля артериального давления, а также коррекция анемии для повышения транспорта кислорода тканям.
За последние годы лечение сердечной недостаточности кардинально изменилось, в частности, изменились взгляды на значение физической активности. Вплоть до 80-х годов увеличение сердца, снижение систолической функции левого желудочка и сердечная недостаточность рассматривались как абсолютные или относительные противопоказания к физическим нагрузкам. Прежние терапевтические схемы предполагали исключение физических нагрузок и постельный режим для больных с разными стадиями сердечной недостаточности. В настоящее время установлено, что продолжительная малоподвижность может приводить к атрофии скелетных мышц, дальнейшему ухудшению
12.... 353
Некоронзрогенные болезни сердца
переносимости физических нагрузок, венозному тромбозу, легочной эмболии и прогрессированию симптомов сердечной недостаточности.
Концепция применения физических тренировок при сердечной недостаточности базируется на современном понимании периферической адаптации при сердечной недостаточности. В настоящее время установлено, что непереносимость физических нагрузок у больных с хронической сердечной недостаточностью имеет много причин, и как изменения на периферии, так и собственно работа левого желудочка являются важными детерминантами переносимости физических нагрузок. Кроме того, все больше появляется доказательств, что нейро-гормональные взаимодействия между периферией и сердцем — также важные детерминанты выраженности симптомов и прогноза у таких больных. Следовательно, вмешательства, которые изменяют эти взаимодействия, в настоящее время рассматриваются как ценные терапевтические подходы, и физические нагрузки являются одними из них.
В течение последних 10 лет были опубликованы результаты нескольких исследований (Cowil M.R. et al., 1997; Cowbura RJ. et al., 1998), в которых показано, что с помощью физических тренировок можно увеличить пик потребления кислорода (VO2), улучшить респираторную функцию и автономный контроль за циркуляцией, связанный со снижением активности симпатической нервной системы и повышением тонуса парасимпатического отдела вегетативной нервной системы, улучшить функцию эндотелия и биохимические и гистологические характеристики скелетных мышц. Все эти эффекты ведут к значительному устранению переносимости физических нагрузок, частичному устранению таких симптомов, как одышка, усталость, нарушения сна и мышечная слабость, повышению функционального класса и улучшению качества жизни. Все опубликованные данные касались использования физических нагрузок у больных со стабильной сердечной недостаточностью. В настоящее время нет исследований, оценивающих физические нагрузки при нестабильной сердечной недостаточности. Суммируя полученные результаты, Рабочая группа по кардиологической реабилитации совместно с Рабочей группой по сердечной недостаточности Европейского общества кардиологов в 2001 г. опубли-
354
Некоронарогенные болезни сердца
ковали рекомендации по проведению физических тренировок у больных с хронической сердечной недостаточностью. К относительным противопоказаниям к использованию физической нагрузки у больных со стабильной сердечной недостаточностью отнесены:
Увеличение массы тела на 1,8 кг и более за предшествующие 1-3 дня.
Сопутствующая постоянная или периодическая терапиядобутамином.
Снижение систолического артериального давления при нагрузках.
IV функциональный класс по NYHA.
Сложные нарушения ритма в покое или появляющиеся при на грузке.
6. Исходная частота сердечных сокращений 100 и более в 1 мин. К абсолютным противопоказаниям отнесены:
Прогрессивное ухудшение переносимости нагрузок или одышка в покое или при нагрузках в течение 3- 5 предшествующих дней.
Значительная ишемия при небольших нагрузках (50 Вт).
Неконтролируемый сахарный диабет.
Острое системное заболевание или лихорадка.
Предшествующие эмболии.
Тромбофлебит.
Активный перикардит или миокардит.
Регургитация на клапанах, требующая хирургического вмешательства.
Вновь возникшая фибрилляция предсердий.
Продолжительность и частота нагрузок зависят от исходного клинического и функционального состояния больного. В соответствии с общими принципами назначения физических нагрузок больным с функциональным резервом 25-40 Вт (по результатам нагрузочных тестов) показан короткий курс упражненией по 5-10 мин, с резервом 40-80 Вт — 1-2 цикла упражнений по 15 мин в день, с резервом более 80 Вт — 3-5 циклов в неделю по 20- 30 мин. Увеличение нагрузок имеет 3 стадии. В начальной стадии интенсивность должна поддерживаться на низком уровне (40- 50% пика VO2) до тех пор, пока продолжительность тренировок достигнет 10-15 мин. Продолжительность и частота тренировок увеличиваются в соответствии с симптомами и клиническим состоянием. Во второй стадии (усиления нагрузок) целью являет-
Некоронарогенные болезни сердца
ся постепенное увеличение интенсивности нагрузок (50% ->60%->70% и при хорошей переносимости даже более от пика VO2), а также увеличение их длительности до 15- 20 мин и при хорошей переносимости до 30 мин. В целом наращивание нагрузок рекомендуется в следующей последовательности: продолжительность, затем частота, затем интенсивность. Третья (поддерживающая) стадия в нагрузочных программах обычно начинается после первых 6 мес тренировок.
Начальные тренировки лучше проводить в условиях стационара под медицинским наблюдением для оценки индивидуальной реакции и переносимости, клинической стабильности. При этом необходимо тщательно регистрировать симптомы, свидетельствующие о необходимости изменения или прекращения нагрузочных программ. Наблюдение должно включать аускультацию легких и сердца, контроль массы тела, наличие периферических отеков, мониторирование сердечного ритма, артериального давления до, во время и после тренировок.
Относительные критерии, при которых рекомендуется начинать нагрузочные тренировки:
• компенсированная сердечная недостаточность в течение по край ней мере 3 нед,
•способность разговаривать без одышки (с частотой дыхания менее 30 в 1 мин),
частота сердечных сокращений в покое не более 100 в 1 мин,
незначительная усталость,
сердечный индекс не менее 2,1 мин/м2 (для инвазивномонитори- руемых больных),
центральное венозное давление < 12 мм рт. ст. (для инвазивномо- ниторируемых больных).
Относительные критерии, при которых необходимо изменить или прекратить тренировки:
выраженная одышка или усталость,
частота дыхания более 40 в 1 мин во время упражнений,
появление III тона или хрипов в легких,
усиление хрипов в легких,
усиление второго компонента II тона,
356
Некоронарогенные болезни сердца
недостаточное пульсовое давление (менее 10 мм рт. ст. между си столическим и диастолическим артериальным давлением),
снижение артериального давления (более 10 мм рт. ст.) во время увеличивающихся нагрузок,
усиление суправентрикулярных или желудочковых экстрасистол во время нагрузок,
• профузное поотделение, бледность, спутанность сознания. Медикаментозное лечение дилатационной кардиомиопатии, по
сути, является лечением сердечной недостаточности. Лечение таких больных зависит от баланса уменьшения нагрузки на сердце (включая постнагрузку), повышения сократительной способности миокарда и уменьшения преднагрузки для достижения оптимального сердечного выброса и предотвращения избыточной задержки в организме соли и воды, системного застоя и застоя в легочных венах.
В последние годы проведен ряд крупных исследований (Gottlieb S.S. et al, 1993; Ferrari R. et al., 1998; Hjalmartou A. et al, 2000) сердечной недостаточности, по результатам которых определены основные группы лекарственных средств, улучшающих состояние больных (табл. 14).
Диуретики остаются средствами первого ряда в лечении сердечной недостаточности независимо от ее тяжести, поскольку это единственная группа препаратов, которые могут адекватно контролировать задержку жидкости при сердечной недостаточности. Применение диуретиков улучшает состояние больных, однако их влияние на выживаемость в крупных рандомизированных исследованиях не изучалось.
Таблица 14. Результаты исследований групп препаратов при сердечной недостаточности
Группа лекарственных препаратов |
Симптомы |
Выживаемость |
Диуретики |
+++ |
? |
Ингибиторы АПФ |
++ |
++ |
Дигоксин |
+ |
0 |
Пщралазин/изосорбида динитрат |
++ |
+ |
Антагонисты рецепторов ангиотензина II |
+ |
+? |
Блокаторы р-адренорецепторов |
+ |
++ |
Амлодипин |
|
0 |
Амиодарон |
|
+/0 |
Примечание: 0 — отсутствие влияния; ? — отсутствие данных; + — умеренный эффект; ++ — выраже н ный эффект; +++ — очень выраженный эффект.
357
Некоронарогенные болезни сердца
Препараты данной группы быстро оказывают клинический эффект — противодействуют задержке натрия и жидкости путем реабсорбции натрия или хлоридов в определенных участках почечных канальцев. Не оказывая прямого влияния на насосную функцию сердца, они снижают преднагрузку, постнагрузку, конечно-диастолическое давление и объем левого желудочка, уменьшают застой крови в малом круге и отеки. Диуретики применяют для поддержания давления наполнения левого и правого желудочков ниже уровня, который вызывает отек легких или значительный застой в печени.
Критериев для назначения диуретиков больным с дилатационной кардиомиопатией и хронической сердечной недостаточностью не существует. Их обычно назначают всем больным с симптомами сердечной недостаточности, у которых есть очевидные признаки или задержка жидкости в анамнезе. При умеренной сердечной недостаточности лечение обычно начинают с тиазидных диуретиков, которые назначают 1-2 раза в неделю. При более выраженной сердечной недостаточности применяют петлевые диуретики (фуросемид или этакриновую кислоту). Лечение обычно начинают с низких доз, которые повышают до тех пор, пока объем мочи увеличивается, а масса тела уменьшается (обычно на 0,5-1 кг/сут). Конечной целью лечения является устранение симптомов и физикальных признаков задержки жидкости за счет нормализации венозного давления в яремной вене и/или ликвидации отеков. Однако мочегонные средства не следует назначать в качестве монотерапии, даже если с их помощью контролируются симптомы сердечной недостаточности и стабилизируется клиническое состояние больного. Диуретики обычно следует сочетать с ингибиторами АПФ и блокаторами р-адренорецепторов. Комбинация диуретиков, которые действуют на различные участки нефрона, позволяет не только добиться синергического эффекта, но и предупредить развитие резистентности, а также возникновение побочных эффектов, главными из которых являются потеря электролитов, нейрогормональная активация, артериальная гипотензия и азотемия. При наличии электролитного дисбаланса его следует активно корректировать, а диуретическую терапию продолжать. Для предупреждения гипокалиемии необходимо комби-
358
Некоронарогенные болезни сердца
пировать тиазиды и фуросемид с низкими дозами калийсберегающих диуретиков.
Резистентность к диуретикам преодолевается их внутривенным введением, применением комбинации двух или более препаратов этой группы, добавлением спиронолактона, применением диуретиков вместе с препаратами, которые усиливают почечный кровоток (например, положительными инотропными агентами — добутамином и допами-ном). После ликвидации задержки жидкости диуретическую терапию следует продолжать в целях предупреждения возникновения повторных эпизодов.
Важную роль в патогенезе сердечной недостаточности играет вторичный гиперальдостеронизм, основными клиническими признаками которого являются выраженный отечный синдром и рефрактерность к петлевым диуретикам. Повышение уровня альдостерона сопровождается задержкой натрия и воды, потерей магния и калия, приводит к активации симпатического и подавлению активности парасимпатического отдела вегетативной нервной системы, нарушению функции ба-рорецепторов, повреждению сосудов и/или нарушению артериальной податливости. В миокарде гиперпродукция альдостерона вызывает структурные изменения, способствует развитию гипертрофии кардио-миоцитов, пролиферации фибробластов и усилению синтеза коллагена (развитию фиброза) с нарушением диастолических свойств левого желудочка, а в периферических сосудах вызывает нарушение целости эндотелия. Спиронолактон является специфическим блокатором аль-достероновых рецепторов, которые помимо почечных канальцев и надпочечников обнаружены в сердце и стенке артерий, он также может тормозить активность альдостеронсинтетазы и таким образом вторично угнетать биосинтез альдостерона. Спиронолактон препятствует про-грессированию фиброза миокарда, замедляет ремоделирование периферических сосудов, улучшает выживаемость.
В рандомизированном двойном слепом плацебо-контролируемом исследовании RALES (Randomised Aldactone Evaluation Study, 1995) изучалось влияние терапии спиронолактоном на уровень смертности при тяжелой сердечной недостаточности IV функционального класса.
359
Некоронарогенные болезни сердца
Исследование включало 1663 больных, у которых к базисной терапии (ингибитор АПФ+диуретик+сердечный гликозид) добавляли спиро-нолактонпо 12,5-25 мгвсутки ежедневно. Исследование прекращено досрочно, так как оказалось, что на фоне приема спиронолактона риск смерти от всех причин снизился на 27%, частота госпитализации в связи с декомпенсацией хронической сердечной недостаточности — на 36%, общее число случаев смерти и госпитализации — на 22%. Смертность от сердечно-сосудистых заболеваний снизилась на 31%, в том числе смертность от прогрессирующей сердечной недостаточности на 35%, риск внезапной смерти — на 29%. Применение антагониста аль-достерона спиронолактона даже в умеренных дозах (75-100 мг в сутки) при тяжелой сердечной недостаточности позволяет преодолеть ре-фрактерность к петлевым диуретикам.
Средства, блокирующие ренин-ангиотензиновую систему, являются наиболее патогенетически обоснованными для лечения сердечной недостаточности. Ингибиторы АПФ играют ключевую роль в долговременной терапии больных с дилатационной кардиомиопатией и систолической дисфункцией независимо от степени ее выраженности. В основе фармакологических эффектов ингибиторов АПФ лежит их способность подавлять активность ангиотензин-1-превращающего фермента (или кининазы II) и таким образом одновременно влиять на функциональную активность ренин-ангиотензиновой и калликреин-кининовой систем. Тормозя активность АПФ, ингибиторы уменьшают образование ангиотензина II и в конечном счете ослабляют основные сердечно-сосудистые эффекты активации ренин-ангиотензиновой системы, а также уменьшают инактивацию брадикинина и других кининов и способствуют накоплению этих веществ в тканях и крови.
Впервые благоприятный эффект ингибитора АПФ эналаприла на прогноз жизни больных с хронической сердечной недостаточностью продемонстрировало исследование CONSENSUS (Cooperative North Scandinavian Enalapril Survival Study, 1987), в котором применение эналаприла снижало смертность больных с тяжелой сердечной недостаточностью в среднем на 27%. Проведенные в дальнейшем контролируемые клинические исследования SOLVD (Studies of Left Ventricular
3 60
Некоронарогенные болезни сердца
Dysfunction, 1990-1991 г.), SAVE (Survival and Ventricular Enlargement, 1992 г.), V-HeFT II (Vasodilator Heart Failure Trial, 1991) подтвердили эти результаты и продемонстрировали значительное снижение заболеваемости и смертности больных с сердечной недостаточностью на фоне лечения ингибиторами АПФ. По обобщенным данным более 30 пла-цебо-контролируемых клинических исследований, включавших более 7000 больных с сердечной недостаточностью, применение ингибиторов АПФ позволяет снизить смертность при хронической сердечной недостаточности в среднем на 23% и уменьшить общее число случаев смерти и госпитализации в связи с декомпенсацией в среднем на 35%. В последние годы ингибиторы АПФ стали стандартом в лечении сердечной недостаточности, поскольку установлены их положительные эффекты на структурно-геометрические и функциональные изменения миокарда, что приводит к повышению функционального класса и переносимости физических нагрузок, замедлению прогрессировать дисфункции левого желудочка, улучшению качества жизни и выживаемости, а также значительному снижению необходимости в их госпитализации в связи с декомпенсацией.
ПОЛОЖИТЕЛЬНЫЕ СЕРДЕЧНО-СОСУДИСТЫЕ
И НЕЙРОЭНДОКРИННЫЕ ЭФФЕКТЫ ИНГИБИТОРОВ АПФ
ПРИ ХРОНИЧЕСКОЙСЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
Сердечно-сосудистые эффекты:
уменьшение общего периферического сосудистого сопротивления (постнагрузки левого желудочка),
снижение давления «заклинивания» легочных капилляров (умень шение преднагрузки левого желудочка),
снижение регионарного сосудистого сопротивления (увеличение кровотока) в сердце, скелетных мышцах, почках, головном мозге,
уменьшение систолического и диастолического объема левого желудочка,
увеличение ударного объема сердца,
увеличение сердечного выброса.
361
Некоронарогенные болезни сердца
Нейроэндокринные эффекты:
уменьшение образования ангиотензина II,
снижение секреции альдостерона,
уменьшение высвобождения норадреналина, аргинин-вазопрес- сина и эндотелина-1,
повышение содержания в тканях и крови брадикинина и других кининов,
•увеличение образования ангиотензина (1-7), простациклина и простагландина Е2,
• задержка калия,
• увеличение экскреции воды, натрия и мочевой кислоты.
Важной задачей лечения сердечной недостаточности является восстановление нормальной функции эндотелия. Ингибиторы АПФ улучшают функцию эндотелия, что предотвращает прогрессирование сердечной недостаточности. Объяснением положительного действия ингибиторов АПФ может быть блокада распада бадикинина: повышение концентрации брадикинина в тканях может увеличивать и стимулировать высвобождение N0 и простагландина. В свою очередь, вазоди-лататоры, N0 могут ингибировать митогенез и стимулировать пролиферацию гладкомышечной ткани сосудов.
В рекомендациях по лечению сердечной недостаточности (эксперты США, 1999) определены следующие положения по применению ингибиторов АПФ у больных с хронической сердечной недостаточностью:
все больные с хронической сердечной недостаточностью, обуслов ленной систолической дисфункцией левого желудочка, должны получать ингибитор АПФ при отсутствии у них непереносимости или противопо казаний к применению. Больным с признаками задержки жидкости (или с указанием на нее в анамнезе) ингибиторы АПФ, как правило, назнача ют в комбинации с диуретиками. Ингибиторы АПФ также рекомендует ся применять у больных с систолической дисфункцией левого желудочка, у которых нет симптомов сердечной недостаточности;
больных, получающих ингибитор АПФ, следует предупредить, что, во-первых, в начале терапии могут отмечаться побочные эффекты, из редка они наблюдаются при длительном применении препарата; во- вторых, улучшение состояния может проявляться лишь после несколь ких недель и даже месяцев терапии; в-третьих, ингибиторы АПФ мо-
362
Некоронарогенные болезни сердца
гут замедлять прогрессирование заболевания даже в тех случаях, когда симптоматика не улучшается;
ингибиторы АПФ показаны для длительной терапии хронической сердечной недостаточности. Эти препараты обычно не применяют для стабилизации состояния больных с острой декомпенсацией («спаси тельная» терапия), например, у больных, находящихся в палате интен сивной терапии, с рефрактерной сердечной недостаточностью и нуж дающихся во внутривенном введении прессорных препаратов;
хотя клинические исследования указывают на то, что все ингиби торы АПФ, вероятно, обладают благоприятными эффектами при сер дечной недостаточности, тем не менее предпочтение следует отдавать «целевым» дозам тех ингибиторов АПФ, эффективность которых оце нивалась в крупномасштабных исследованиях.
Ингибиторы АПФ должны применяться с осторожностью у больных с очень низким системным артериальным давлением (систолическое артериальное давление < 80 мм рт. ст.), значительно повышенным уровнем креатинина в сыворотке крови (> 3 мг/дл), билатеральным стенозом почечной артерии, повышенным уровнем калия в сыворотке крови (> 5,5 ммоль/л).
Начинать лечение ингибиторами АПФ следует с низких доз под контролем артериального давления, удваивая дозу каждые 3-7 дней при хорошей переносимости и титруя их до целевых (для эналаприла — 20 мг/сут,длякаптоприла— 150мг/сут).
Наиболее частыми побочными эффектами ингибиторов АПФ, которые потенциально могут ограничивать их применение, являются артериальная гипотензия, ухудшение функции почек, сухой кашель, ангио-невротический отек. Наименее выраженным гипотензивным эффектом после приема первой дозы обладает периндоприл, что обусловлено особенностями его химической структуры.
Антагонисты рецепторов ангиотензина II — новая группа лекарственных препаратов, применение которых считается перспективным при терапии хронической сердечной недостаточности. Они более эффективно подавляют эффекты ренин-ангиотензиновои системы, так как действуют на уровне клеточных рецепторов и ослабляют эффекты ангиотензина II независимо от метаболических путей его образования.
363
Некоронарогенные болезни сердца
Первый антагонист лосартан синтезирован в 1988 г. В середине 90-х годов были завершены клинические испытания других антагонистов: вал-сартана, ирбесартана, кандесартана, телмисартана.
После исследования ELITE (Evaluation of Losartan in the Elderly, 1997) на антагонисты рецепторов ангиотензина II возлагались большие надежды в плане преимущества их перед ингибиторами АПФ — улучшения выживаемости при сердечной недостаточности. Однако различия в показателях выживаемости не были подтверждены в исследовании ELITE II (1999).
Исследование RESOLVD (Randomised Evaluation of Strategy for Lert Ventricular Dysfunction, 1997, 1999) было прекращено досрочно, поскольку не были получены доказательства благоприятного влияния кандесартана (как при монотерапии, так и в комбинации с эналапри-лом) на смертность и/или частоту госпитализации в связи с декомпенсацией по сравнению с терапией эналаприлом у больных с хронической сердечной недостаточностью.
В настоящее время не накоплен достаточный опыт применения антагонистов рецепторов ангиотензина II в контролируемых клинических исследованиях больных с сердечной недостаточностью. Следовательно, результаты этих исследований не позволяют рекомендовать широкое использование любых антагонистов рецепторов ангиотензина 11 для лечения хронической сердечной недостаточности вместо ингибиторов АПФ.
Мнение экспертов США о значении антагонистов рецепторов ангиотензина II в современной терапии хронической сердечной недостаточности определяется следующими положениями:
нет убедительных доказательств, что антагонисты рецепторов ан гиотензина II сравнимы или превосходят по эффективности ингиби торы АПФ при лечении сердечной недостаточности, поэтому их не сле дует использовать при лечении сердечной недостаточности у больных, которые прежде не получали ингибиторов АПФ, а больных, которые хорошо переносят ингибиторы АПФ, не следует переводить на антаго нисты рецепторов ангиотензина II;
в связи с отсутствием окончательных данных об их эффективнос ти при сердечной недостаточности использование этих препаратов
364
Некоронарогенные болезни сердца
вместо ингибиторов АПФ оправдано лишь у больных с повышенной чувствительностью к ингибиторам АПФ (ангионевротический отек или мучительный кашель). Антагонисты рецепторов ангиотензина II, по-видимому, так же, как и ингибиторы АПФ, вызывают артериальную гипотензию, гиперкалиемию и ухудшают функцию почек.
Сердечные гликозиды являются единственными инотропными препаратами, пригодными для длительного применения у больных с сердечной недостаточностью. При их назначении происходит повышение сократимости миокарда, снижение частоты сердечных сокращений и замедление AV-проводимости, что сопровождается улучшением клинической симптоматики. Считается, что положительный инотропный эффект сердечных гликозидов опосредуется через сопряжение возбуждения и сокращения: они подавляют трансмембранное движение ионов натрия и калия, угнетая натриево-калиевую АТФазу (фермент, обеспечивающий транспорт моновалентных катионов), которая является рецептором для сердечных гликозидов, и воздействие на них приводит к повышению уровня внутриклеточного натрия и к повышению — ионов кальция внутри клетки.
Сердечные гликозиды вызывают изменения электрических свойств сократительных клеток и клеток «специализированной» автоматической ткани, увеличивают эффективный рефрактерный период атрио-вентрикулярного узла, что объясняется главным образом усилением влияния на сердце блуждающего нерва.
При сердечной недостаточности сердечные гликозиды нормализуют опорожнение желудочков, стимулируя сократительную функцию миокарда, следствием чего являются увеличение сердечного выброса, диуреза, снижение повышенного диастолического давления и объема желудочка. Таким образом, при сердечной недостаточности сердечные гликозиды оказывают многоплановое положительное воздействие:
позитивное инотропное действие,
увеличивают минутный объем крови, снижают преднагрузку,
повышают чувствительность барорецепторов,
снижают повышенную активность нейрогуморальных систем — ре нин-ангиотензиновой и симпатоадреналовой,
365
Некоронарогенные болезни сердца
снижают активность предсердного натрийуретического фактора,
увеличивают плотность рецепторов лимфоцитов,
увеличивают диурез,
повышают толерантность к физической нагрузке,
не ухудшают выживаемость.
Дигоксин показан больным с дилатационной кардиомиопатией с явлениями декомпенсации и нарушением сердечного ритма. При его приеме исчезают симптомы застоя в легочном круге кровообращения, снижается системное венозное давление. У больных с мерцанием и трепетанием предсердий назначение сердечных гликозидов позволяет уменьшить частоту сокращений желудочков.
Многоцентровое рандомизированное двойное слепое плацебо-конт-ролируемое исследование DIG (Digitalis Investigation Group, 1997), включавшее 7788 больных с хронической сердечной недостаточностью и синусовым ритмом, получавших дигоксин в суточной дозе 0,125-0,5 мг, показало, что препарат не влияет на общую и кардиологическую смертность (значимо не ухудшает прогноз заболевания), вместе с тем обладает высокой клинической эффективностью, снижает смертность от прогрессирующей сердечной недостаточности, частоту случаев госпитализации в связи с декомпенсацией хронической сердечной недостаточности. Дигита-лисная интоксикация развивалась достаточно редко.
В последнее время некоторые исследователи высказывали сомнение в необходимости постоянного приема сердечных гликозидов при хронической сердечной недостаточности, однако было бы неправильным ограничивать показания к назначению сердечных гликозидов только та-хисистолической формой фибрилляции предсердий. Следует помнить, что отмена сердечных гликозидов у больных с дилатационной кардиомиопатией как с синусовым ритмом, так и с фибрилляцией предсердий и низкой фракцией выброса приводит к нарастанию симптомов декомпенсации сердечной деятельности, что было показано в многоцентровых плацебо-контролируемых исследованиях у больных, получавших сердечные гликозиды в сочетании с диуретиками (PROVED, 1993) или диуретиками и ингибиторами АПФ (RADIANCE, 1993).
Дигоксин обладает умеренно выраженным антиаритмическим действием на желудочковые аритмии у больных с ранними стадиями сер-
366
Некоронарогенные болезни сердца
дечной недостаточности. Однако следует помнить, что применение сердечных гликозидов у больных с тяжелой сердечной недостаточностью (выраженной дилатацией левого желудочка) может привести к неблагоприятным последствиям, когда инотропный эффект препаратов этой группы бывает слабым, в то время как аритмогенное действие (увеличение числа желудочковых аритмий) проявляется даже при низких концентрациях дигоксина. Сердечные гликозиды мало эффективны при нарушении диастолического наполнения левого желудочка.
J. МсМштауи М. Petrie (1997) рекомендуют назначать дигоксин при хронической сердечной недостаточности:
всем больным с мерцанием предсердий, у которых необходим контроль за ритмом сокращения желудочков;
больным с умеренной или тяжелой хронической сердечной недо статочностью (III- IV функциональный класс):
а) если симптомы хронической сердечной недостаточности сохра няются несмотря на терапию диуретиками и ингибиторами АПФ,
б) если они более 1 раза госпитализировались в связи с декомпенса цией хронической сердечной недостаточности,
в) если у них имеется тяжелая систолическая дисфункция левого желудочка (фракция выброса менее 25%) или сохраняется кардиоме- галия (кардиоторакальный индекс более 0,55 по данным рентгеногра фии органов грудной клетки).
Таким образом, дигоксин рекомендовано использовать для улучшения клинического состояния больных с хронической сердечной недостаточностью, вызванной систолической дисфункцией левого желудочка, в сочетании с диуретиками и ингибиторами АПФ, блокаторами β-aдpeнopeцeптopoв. Также рекомендуется назначать его больным с хронической сердечной недостаточностью и тахисистолической формой мерцания предсердий.
Негликозидные инотропные препараты оказывают более выраженное кардиотоническое действие, чем сердечные гликозиды, поэтому одно время они считались более перспективными для улучшения нарушенной сократительной функции левого желудочка у больных с хронической сердечной недостаточностью.
В 80- 90-е годы было выполнено несколько крупных рандомизированных плацебо-контролируемых исследований, в которых у больных
367
Некоронарогенные болезни сердца
с хронической сердечной недостаточностью III- IV функционального класса изучали эффективность, переносимость и безопасность длительной терапии различными агонистами β-адренергических (ксамотерол) и DA-допаминергических рецепторов (ибопамин), ингибиторами фосфодиэстеразы (амринон, милринон) и других препаратов со сложным или неизвестным механизмом положительного инотропного действия (веснаринон, пимобендан, флозеквинан). Почти во всех исследованиях наблюдался более высокий показатель смертности больных с хронической сердечной недостаточностью, получавших негли-козидные инотропные препараты, по сравнению с группами контроля.
В плацебо-контролируемом исследовании Xamoterol in Severe Heart Failure Study (1990) β-адреномиметик ксамотерол достоверно увеличивал число случаев смерти больных с сердечной недостаточностью III-IV функционального класса, поэтому по решению этического комитета исследование было досрочно прекращено.
Известно, что ингибиторы фосфодиэстеразы (амринон, милринон, эноксимон) повышают инотропную функцию сердца, оказывают ва-зодилатирующее действие и благодаря снижению пред- и постнагрузки не влияют на потребление миокардом кислорода. В рандомизированном многоцентровом исследовании PROMISE (Prospective Randomized Milrinone Survival Evaluation, 1991), включавшем 1088 больных с сердечной недостаточностью III- IV функционального класса и фракцией выброса менее 0,35, применение милринона в течение 6 мес повышало риск общей смертности на 28%, в результате сердечно-сосудистых заболеваний — на 34%, а риск внезапной смерти — на 69%, в то время как показатель смертности от прогрессирующей сердечной недостаточности не изменился. Исследование было завершено досрочно.
В плацебо-контролируемом исследовании PICO (Pimobendan In Congestive heart failure) изучалась эффективность пимобендана, в основе положительного инотропного действия которого, вероятно, лежат торможение активности фосфодиэстеразы и повышение чувствительности миофибрилл к кальцию. Смертность от всех причин при назначении пимобендана на фоне ингибиторов АПФ, диуретиков и сердечных гликозидов была в 1,8 раза выше, чем в контрольной группе. Прогрессирующая сердечная недо-
368
Некоронарогенные болезни сердца
статочность была причиной смерти в 19% случаев в группе больных, получавших пимобендан, и в 9% случаев в группе плацебо.
Эффективность и безопасность длительного применения веснари-нона, механизм положительного инотропного действия которого связывают с торможением активности фосфодиэстеразы и блокадой калиевых каналов кардиомиоцитов, оценивали в 2 рандомизированных исследованиях — VesSG (Vesnarinon Study Group) и VEST (Vesnarinone Evaluation of Survival Trial). В обоих продолжающихся исследованиях отмечали увеличение числа случаев смерти среди больных с хронической сердечной недостаточностью, получавших веснаринон, последнее исследование было прекращено досрочно.
Флозеквинан является прямым вазодилататором, который оказывает положительное ино- и хронотропное действие. Его эффективность, переносимость и безопасность изучали в нескольких рандомизированных плацебо-контролируемых исследованиях — REFLECT (Randomized Evaluation of Flosequinan on Exercise Tolerance, 1993), FACET (Flose-quinan-Angiotensin Converting Enzyme inhibitor Trial, 1993), PROFILE (Prospective Randomized Flosequinan Longevity Evaluation). В группах больных, получавших флозеквинан, отмечена более высокая смертность.
В крупном рандомизированном исследовании PRIME-II (Second Prospective Randomized study of Ibopamine on Mortality and Efficacy) изучали влияние агониста DA1,- и DА2-допаминергических рецепторов ибо-памина на выживаемость больных с хронической сердечной недостаточностью. Исследование было досрочно прекращено после выявления более высокой смертности в группе больных, получавших ибопамин.
Для повышения сократимости миокарда при тяжелых формах сердечной недостаточности используют 4 основных симпатомиметичес-ких амина, действующих преимущественно на β-адренорецепторы: эпинефрин, изопреналин, допамин, добутамин. Лечение этими препаратами необходимо проводить в условиях отделения интенсивной терапии под тщательным мониторингом ЭКГ, поскольку их вводят посредством постоянной внутривенной инфузии. Несмотря на определенные гемодинамические сдвиги, положительное их влияние на выживаемость не доказано. Для длительного лечения сердечной недо-
3 69
Некоронарогенные болезни сердца
статочности препараты непригодны, поскольку постоянный прием обычно сопровождается снижением чувствительности соответствующих рецепторов. Помимо этого, они увеличивают потребность миокарда в кислороде на 25- 30%, а также обладают достаточно выраженным аритмогенным действием.
Таким образом, результаты применения негликозидных инотроп-ных препаратов оказались негативными. Длительное лечение бета-ад-реномиметиками или ингибиторами фосфодиэстеразы повышает уровень смертности больных с сердечной недостаточностью. Эти препараты можно считать средствами выбора для краткосрочного лечения в тяжелых случаях, в то время как их широкое применение при хронической сердечной недостаточности вряд ли оправдано, и они не являются реальной альтернативой сердечным гликозидам при необходимости длительной поддерживающей терапии.
Применение периферических вазодилататоров патогенетически оправдано при сердечной недостаточности, поскольку у таких больных повышается общее периферическое сосудистое сопротивление в результате компенсаторной активации адренергической и ренин-ан-гиотензиновой систем. Повышение сосудистого тонуса способствует стабилизации артериального давления и перераспределению кровотока к жизненно важным органам в условиях низкого сердечного выброса, но одновременно оказывает негативное влияние на насосную функцию сердца. Вазодилататоры, снижающие пред- и постнагрузку на сердце, у больных с сердечной недостаточностью значительно повышают ударный объем и сердечный выброс.
Нитраты (нитроглицерин, изосорбид динитрат, изосорбид-мононитрат) являются преимущественно венозными вазодилататорами, расширяют емкостные сосуды, снижают венозный возврат и давление наполнения желудочков и в меньшей мере влияют на сердечный выброс.
Артериальные вазодилататоры (гидралазин, миноксидил) расширяют резистивные сосуды, снижают постнагрузку, увеличивают сердечный выброс, в то время как давление наполнения желудочков не меняется.
Единственный положительный опыт комбинированного применения венозных и артериальных вазодилататоров был получен в рандо-
370
Некоронарогенные болезни сердца
мизированном ветеранском исследовании V-HeFT I (Vasodilator Heart Failure Trial, 1986) с участием 642 больных с застойной сердечной недостаточностью. Больным назначали празозин (20 мг/сут), гидралазин (300 мг/сут) в сочетании с изосорбида динитратом (160 мг/сут) или плацебо, длительность наблюдения составила в среднем 2,3 года. Результаты показали, что лечение гидралазином и изосорбида динитратом приводило к значительному увеличению фракции выброса левого желудочка и снижению риска смерти больных (через год на 38%). В то же время лечение празозином не повлияло ни на показатели насосной функции сердца, ни на выживаемость больных с сердечной недостаточностью. Таким образом, эффективность изолированного назначения препаратов не доказана.
В настоящее время комбинация венозных и артериальных вазодилататоров — гидралазина и изосорбида динитрата — не должна применяться для лечения сердечной недостаточности у больных, которые до этого не принимали ингибиторы АПФ, и не должна заменять ингибиторы АПФ у больных, которые их хорошо переносят. Комбинация гидралазина и изосорбида динитрата у больных с сердечной недостаточностью показана при непереносимости ингибиторов АПФ.
К числу мощных вазодилататоров относят антагонисты ионов кальция, однако данные клинических исследований при сердечной недостаточности оказались неудовлетворительными. До настоящего времени не доказана способность этих препаратов улучшать клиническую симптоматику или выживаемость, длительное использование короткодействующих форм повышает риск прогрессирования сердечной недостаточности и смерти. Определенные надежды возлагались на антагонисты кальция второго поколения, оказывающие селективное действие на сосуды (амлодипин, фелодипин).
Действие фелодипина изучали в рандомизированном плацебо-контролируемом исследовании V-HeFT III (1996) на протяжении 18 мес У 451 больного с тяжелой сердечной недостаточностью. Фелодипин назначали по 5 мг 2 раза в сутки на фоне ингибитора АПФ. Применение фелодипина не оказывало влияния на показатель общей смертности больных, не улучшало клиническое состояние больных (по результатам пробы с нагрузкой на тредмиле).
Некоронарогенные болезни сердца
Влияние амлодипина на показатели заболеваемости и смертности при тяжелой сердечной недостаточности изучали в многоцентровом рандомизированном плацебо-контролируемом исследовании PRAISE (1996) с участием 1153 больных с сердечной недостаточностью и фракцией выброса < 30%.
Амлодипин назначали по 5-10 мг в сутки в среднем 13,8 мес. Результаты показали, что длительное применение амлодипина у больных с дилатационной кардиомиопатией приводило к снижению риска смерти на 46%, однако полученные данные рассматривались как предварительные. В исследовании PRAISE II (2000), которое включало 1652 больных с сердечной недостаточностью III- IV функционального класса со средней фракцией выброса 21 %, не было выявлено различий в частоте общей и кардиальной смертности среди больных, получавших амлодипин или плацебо. По заключению исследователей, амлодипин не является специфическим средством для улучшения симптомов или исхода при хронической сердечной недостаточности, обусловленной дилатационной кардиомиопатией.
Таким образом, из-за отсутствия доказательств эффективности антагонистов ионов кальция они не показаны для лечения больных с сердечной недостаточностью.
Большой интерес представляют результаты применения блокаторов β-aдpeнopeцeптopoв для лечения сердечной недостаточности. До недавнего времени сама идея их применения была абсурдной из-за того, что считалось, что эти препараты оказывают отрицательное инотроп-ное действие на сократительную функцию миокарда и нарушают перфузию органа.
Количество сообщений о положительной роли блокаторов β-адрено-рецепторов постоянно увеличивается. В настоящее время эффективность блокаторов β-aдpeнopeцeптopoв изучена приблизительно у 10 000 больных с сердечной недостаточностью и фракцией выброса менее 35-45%, которые были включены в более чем 20 плацебо-контролируемых клинических исследований. Все больные получали диуретики, ингибиторы АПФ с дигиталисом или без. Результаты показали, что как и лечение ингибиторами АПФ, длительная терапия блокаторами β-адренорецетт-
372
Некоронарогенные болезни сердца
т оров может уменьшать выраженность симптомов и улучшать клиническое состояние больных с хронической сердечной недостаточностью. Они снижают риск смерти, а также комбинированный риск смерти и госпитализации. Положительные эффекты блокаторов β-адренорецеп-торов наблюдались у больных, получавших ингибиторы АПФ. Это предполагает, что комбинированное ингибирование двух нейрогормональ-ных систем может вызывать дополнительные эффекты.
Завершены широкомасштабные исследования метопролола (MDC — Metoprolol in Idiopathic Dilated Cardiomyopathy, 1993) и бизопролола (CIBIS — Cardiac Insufficiency Bisoprolol Study, 1994), результаты которых продемонстрировали, что эти препараты замедляют прогрессирова-ние хронической сердечной недостаточности у больных с дилатационной кардиомиопатией.
В рандомизированном многоцентровом исследовании MERIT-HF (Metoprolol CR/XL Randomized Intervention Trial in Heart Failure, 1999) с участием 3991 больного с хронической сердечной недостаточностью продемонстрировано снижение показателя смертности на 35% на фоне применения метопролола, из-за чего исследование досрочно прекращено. Данные рандомизированного исследования CIBISII (1994), проведенного у 2647 больных в течение 16 мес, показали, что прием бизопролола в дозе 1,25-10 мг в сутки на фоне ингибитора АПФ, диуретика, вазодилата-тора приводит к снижению общей смертности на 34%, числа случаев госпитализаций по любой причине на 20 %, частоты случаев внезапной смерти от сердечно-сосудистых заболеваний на 47%. Исследование досрочно прекращено, поскольку было показано, что бизопролол в дополнение к обычным средствам, применяемым для лечения хронической сердечной недостаточности, увеличивает продолжительность жизни.
К основным механизмам действия блокаторов β-адренорецепторов при дилатационной кардиомиопатии можно отнести:
блокаду нейроэндокринных систем: симпатоадреналовой, ренин- ангиотензиновой, альдостероновой, вазопрессина;
улучшение биоэнергетики мокарда — увеличение количества мак- роэргических фосфатов в миокарде, необходимых для синтетичес ких и репаративных процессов;
Некоронарогенные болезни сердца
у величение плотности β-адренорецепторов миокарда;
уменьшение частоты сердечных сокращений;
улучшение диастолического расслабления и наполнения желудоч ков, улучшение синхронности сокращения;
блокаду вазоконстрикции, вызванной катехоламинами;
защиту миокарда от повреждения катехоламинами — предотвра щение катехоламининдуцированной токсичности/апоптоза кар- диомиоцитов;
восстановление чувствительности β-адренорецепторов к симпа- томиметикам;
антиаритмическое действие — предупреждение потенциально опасных желудочковых аритмий.
Некоторые исследования показали, что блокаторы β-адренорецеп-торов в низких дозах могут улучшать состояние тех больных с дилата-ционной кардиомиопатией, у которых выраженный компенсаторный адренергическии ответ вызывает хроническое угнетение активности β-адренорецепторовкардиомиоцитов.
Одним из самых перспективных препаратов для лечения хронической сердечной недостаточности исследователи считают карведилол, обладающий свойствами неселективного блокатора β-адренорецепторов без собственной симпатомиметической активности, селективного блокатора (антагониста) а,-адренорецепторов, антиоксиданта, антиаритмического средства.
Карведилол оказался гораздо эффективнее других блокаторов β-atf-ренорецепторов в плане ослабления процессов апоптоза благодаря прямому антиоксидантному действию, не связанному с адреноблокирую-щими механизмами; доказано, что карведилол устраняет избыток свободных кислородных радикалов, уменьшая оксидантный стресс. Кроме того, карведилол обладаетантипролиферативными свойствами, улучшает функцию эндотелия, что может быть важным для предотвращения прогрессирующей перестройки сосудов, которая усиливает гемодинами-ческие нарушения при сердечной недостаточности. Предварительные исследования карведилола при хронической сердечной недостаточности, проведенные в США, Австралии и Новой Зеландии с участием около 800 больных с легкой и умеренной сердечной недостаточностью, пока-
~374
Некоронарогенные болезни сердца
зал и, что он значительно улучшает функциональное состояние больных, снижает риск общей смертности, частоту госпитализации.
В плацебо-контролируемом исследовании PRECISE (Prospective Randomized Evaluation of Carvediolon Symptoms and Exercise, 1996) назначение карведилола у 278 больных с умеренной и тяжелой сердечной недостаточностью на 39% снижало комбинированный риск смерти и госпитализации в связи с любыми причинами и на 46% — число случаев госпитализации в связи с сердечно-сосудистой патологией.
В плацебо-контролируемом исследовании MOCHA (Multicenter Oral Carvediol Heart Failure Assessment, 1996) назначение карведилола у 345 больных с умеренной и тяжелой сердечной недостаточностью снижало общую смертность на 73% и госпитализацию в связи с сердечнососудистой патологией на 45%.
Обобщение данных по выживаемости были основанием для досрочного прекращения 4 многоцентровых исследований в США, так как терапия карведилолом на 65% снижала риск смерти.
Среди основных механизмов действия карведилола можно отметить:
ингибирование нейрогормональных путей (ренин-ангиотензино- вой системы, симпатического отдела вегетативной нервной сис темы, эндотелиновой системы);
снижение общего периферического сосудистого сопротивления и уменьшение преднагрузки;
уменьшение потребности миокарда в кислороде;
отсутствие рефлекторной тахикардии;
угнетение нарушений ритма сердца;
торможение апоптоза кардиомиоцитов;
угнетение пролиферации гладко мышечных клеток;
торможение образования свободных кислородных радикалов;
замедление прогрессирования сердечной недостаточности.
В исследовании COPERNICUS (Carvedilol Prospective Randomized Cumulative Survival Trial, 2000) карведилол применяли у более чем 2000 больных с фракцией выброса менее 25% и выраженными симптомами сердечной недостаточности. Это первое крупное исследование по при-
Некоранарогенные болезни сердца
менению блокаторов β-адренорецепторов специально у больных с тяжелой хронической сердечной недостаточностью. Исследование было закончено досрочно в связи с явным преимуществом карведилола по сравнению с плацебо.
В настоящее время для подтверждения гипотезы, что блокада нескольких рецепторов имеет преимущества перед блокадой одного рецептора, проводится большое исследование COMET (Carvedilol or Metoprolol European Trial), в котором сравниваются эффекты карведилола и метопролола у более чем 3000 больных с хронической сердечной недостаточностью при длительности лечения около 4 лет. Результаты будут получены в 2001 г.
По современным представлениям все больные с сердечной недостаточностью вследствие систолической дисфункции левого желудочка должны получать блокаторы β-aдpeнopeцeптopoв кроме случаев, когда они им противопоказаны или плохо переносятся. Блокаторы р-ад-ренорецепторов обычно назначаются совместно с диуретиками и ингибиторами АПФ.
Больные, получающие блокаторы β-адренорецепторов, должны знать, что:
побочные эффекты могут возникать в ранний период лечения, но в целом не препятствуют длительному приему препарата;
симптоматическое улучшение может не проявляться до 2- 3 мес лечения;
препараты могут снижать риск прогрессирования заболевания даже при отсутствии улучшения клинической симптоматики.
Блокаторы β-адренорецепторов показаны для длительного лечения хронической сердечной недостаточности. Их не следует назначать при декомпенсации, включая больных, нуждающихся в интенсивной терапии, внутривенном введении прессорных препаратов, а также с рефрактерной сердечной недостаточностью.
Исходя из результатов научных исследований, для лечения хронической сердечной недостаточности рекомендовано использовать мето-пролол, бизопролол и карведилол. Положительный эффект других пре-
576
Некоронарогенные болезни сердца
паратов этой группы (например, атенолола, небиволола, целипроло-ла) не доказан.
Лечение блокаторами β-адренорецепторов начинают с низких доз — 5 мг метопролола, 1,25 мгбизопролола, 3,125 мг карведилола. Терапию блокаторами β-адренорецепторов у больных с дилатационной кардио-миопатией следует начинать в стационаре под наблюдением врача. Механизм, при котором медленное титрование дозы препарата предупреждает развитие побочных эффектов, неизучен. Выбор режима дозирования целиком базируется на эмпирических наблюдениях. Начало приема препарата в полной дозе часто приводит к усилению выраженности признаков сердечной недостаточности, артериальной гипотен-зии, синкопальному состоянию. Этих симптомов удается избежать при достижении эффективной суточной дозы в течение нескольких месяцев. Начинать следует с 1|8 средней терапевтической дозы, удваивая дозу до оптимальной каждые 2- 3 нед.
В течение 6- 12 нед дозы блокаторов β-адренорецепторов постепенно повышают. Рекомендуется пользоваться схемами назначения препаратов, апробированными в крупных рандомизированных плацебо-контролируемых исследованиях (табл. 15).
Начало терапии блокаторами β-aдpeнopeцeптopoв может сопровождаться клиническим ухудшением у 10- 20% больных, что проявляется снижением пика физических возможностей, усугублением застоя в легких,
Таблица 15. Схема назначения блокаторов β-адренорецепторов больным с хронической сердечной недостаточностью
Дозирование |
Метопролол, мг/сут |
Бизопролол, мг/сут |
Карведилол, мг/сут |
Первая доза, мг |
5 |
1,25 |
3,125 |
1-я неделя |
10 |
1,25 |
6,25 |
2-я неделя |
15 |
2,5 |
6,25 |
3-я неделя |
30 |
3,75 |
12,5 |
4-я неделя |
50 |
5 |
12.5 |
5-я неделя |
75 |
5 |
25 |
6-я неделя |
100 |
5 |
25 |
7-я неделя |
150 |
5 |
50 |
8-11-я неделя |
150 |
7,5 |
50 |
12-15-я неделя |
150 |
10 |
50 |
Целевая доза |
100-150 |
10 |
50 |
Некоронарогенные болезни сердца
усилением утомляемости, увеличением периферических отеков и как следствие — ухудшением качества жизни. Однако при дальнейшем лечении риск кратковременного гемодинамического ухудшения исчезает.
Улучшение состояния нередко отмечается только через 3-4 мес приема препаратов. Наивысший эффект достигается у больных молодого возраста с дилатационной кардиомиопатией с небольшой длительностью заболевания, уженщин эффективность более выражена, чем у мужчин.
В настоящее время перспективным направлением является активация нейрогуморальной системы натрийуретических факторов (пред-сердного, мозгового и сосудистого) — блокада нейроэндопептидазы, разрушающей их до неактивных метаболитов. Новый класс нейрогор-мональных модуляторов получил название ингибиторов вазопептидаз, первый из них омапатрилат, который угнетает АПФ и нейтральную пептидазу, снижая уровень ангиотензина II и в то же время повышая уровень натрийуретических пептидов, брадикинина и адреномедулли-на. Омапатрилат проходит III фазу клинических испытаний (исследования IMPRESS, OVERTURE), результаты которых позволят более точно определить место этого препарата среди других современных средств лечения хронической сердечной недостаточности.
Течение дилатационной кардиомиопатии часто осложняют системные тромбоэмболии и внутрисердечный тромбоз. При возникновении тромбоэмболии показано назначение непрямых антикоагулянтов в дозах, достаточных для снижения протромбинового индекса примерно до 50%, увеличение протромбинового времени в 1,3-1,5 раза. Антикоагулянты назначают профилактически для предотвращения системной или легочной эмболии, поскольку при значительной дилатации камер сердца образование тромбов отмечается достаточно часто.
При аритмиях сердца, которые часто осложняют как острую мио-кардитическую фазу миопатии, так и позднюю хроническую дилата-ционную фазу, назначают антиаритмические средства. Следует учитывать, что большинство антиаритмических средств оказывают депрессивное действие на сократимость миокарда, поэтому средства с отрицательным инотропным эффектом (дизопирамид и прокаинамид) лучше не назначать. Предпочтение отдают амиодарону, который эф-
378
Некоронарогенные болезни сердца
фективен в отношении как супра-, так и желудочковых аритмий, не ухудшает сократительную способность миокарда и обладает свойствами периферического вазодилататора. Если блокада сердца осложняется хронической дилатационной фазой, может понадобиться имплантация постоянного водителя ритма.
Имеются сведения об эффективности при сердечной недостаточности цитопротекторных препаратов триметазидина и милдроната.
Таким образом, в течение последних 10 лет изучения сердечной недостаточности мы стали свидетелями разрушения почти всех «классических» и «фундаментальных» концепций, которые сопровождали понимание этого синдрома:
нейроэндокринная реакция, которая раньше рассматривалась как компенсаторная реакция организма для борьбы с условиями «не достаточности», сейчас воспринимается как неблагоприятная ре акция организма, которая требует коррекции;
позитивные инотропные лекарства, которые были избраны как логическое медикаментозное лечение для пораженного сердца, вы зывают, что парадоксально, увеличение числа случаев смерти при длительном применении и в настоящее время не рассматривают ся как препараты выбора;
•блокаторы бета-адренорецепторов, ранее рассматриваемые как неприемлемые препараты вследствие их отрицательного инотроп-ного эффекта, сейчас улучшают прогноз, усиливают положительный инотропный эффект, когда назначаются длительно, что обусловило рекомендации к их применению;
• новые знания о функции эндотелия повлияли на то, что старые и логичные рекомендации «лежать в постели» сейчас рассматрива ются как устаревшие, и пациентам рекомендуют циклы реабили тационных физических упражнений.
В настоящее время разрабатываются новые стратегические подходы к лечению сердечной недостаточности:
ингибиторы симпатической активности центральной нервной си стемы;
антагонисты рецепторов вазопрессина;
179
Некоронарогенные болезни сердца
антагонисты А- и В-рецепторов эндотелина;
ингибиторы эндотелинпревращающего фермента;
ингибиторы протонного насоса;
комбинационная терапия;
методы иммуномодулирующей терапии.
Поскольку прогноз при дилатационной кардиомиопатии неблагоприятный и никакая терапия не предотвращает летального исхода, эти больные представляют наибольшую группу реципиентов для трансплантации сердца. На благоприятный исход операции можно рассчитывать у больных без сопутствующих системных заболеваний, нарушений психики, высокого необратимого сопротивления легочных сосудов, у пациентов моложе 60 лет.
Некоронарогенные болезни сердца
