
- •Практическая работа №1
- •Материальное обеспечение:
- •Практическая работа №2
- •Материальное обеспечение:
- •Практическая работа №3
- •Материальное обеспечение:
- •Типы гидролиза солей
- •Практическая работа №4
- •Практическая работа №5
- •Материальное обеспечение:
- •Практическая работа №6
- •Материальное обеспечение:
- •Приложения
Материальное обеспечение:
Краткий справочник физико-химических величин / Под редакцией К. П. Мищенко и А. А. Равделя, Л. : Химия, 1974. – 200 с.
Периодическая система химических элементов Д. И. Менделеева.
Задание
Научиться выполнять типовые задания по данной теме:
Определение степени окисления веществ, прогнозирование их свойств в реакциях с другими веществами.
Составление уравнений окислительно-восстановительных реакций.
Порядок выполнения работы
Примеры решения типовых заданий
Задание №1.
Определите степень окисления всех элементов в соединениях: P2O5, MnSO4, МnО2, КМnО4, KNO2, NH4NO3, KNO3, K2Cr2O7, K2CrO4, Nа2SO3.
Алгоритм решения.
Степень окисления – формальный заряд атома в молекуле. Сумма зарядов всех атомов в молекуле равна О. Сумма зарядов атомов в ионе равна заряду иона.
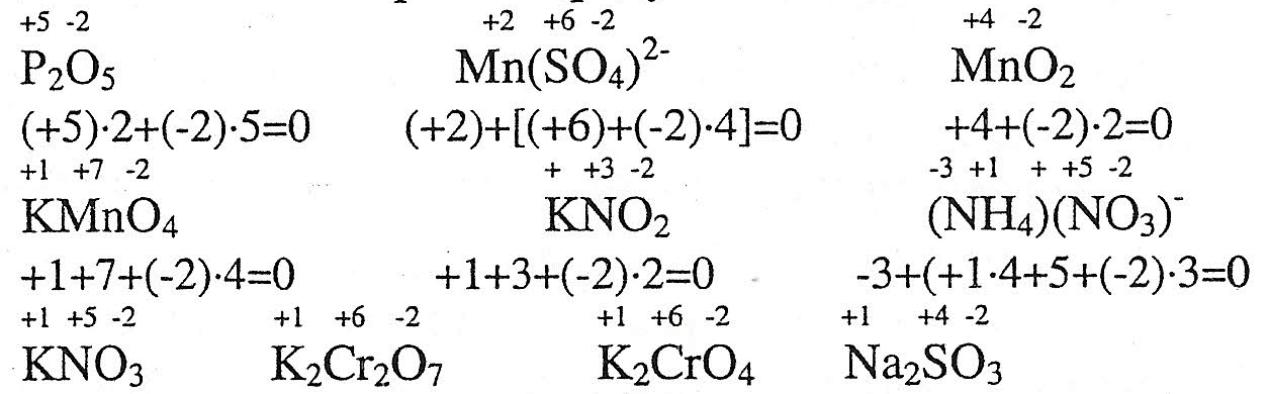
Задание №2.
Укажите, какое соединение может быть только окислителем, только восстановителем, или и тем, и другим: KNO2, HNO3, CrCl3, K2CrO4, H2S, SO2, H2SO4, MnSO4, МnО2, К2МnО4, КМnО4.
Алгоритм решения.
Если степень окисления низшая отрицательная, то атом может быть только восстановителем, отдает электроны, принимать их не может.
Если степень окисления высшая положительная, то атом может быть только окислителем, принимает электроны, отдавать ему уже нечего.
Если степень окисления занимает промежуточное значение, то атом может быть окислителем и восстановителем, то есть и принимать, и отдавать электроны.
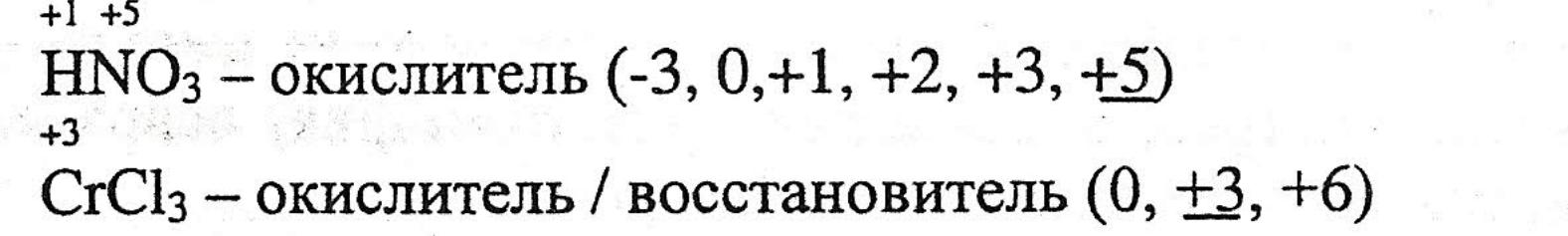

Задание №3.
Составить уравнение окислительно-восстановительной реакции, протекающей между перманганатом калия и иодидом калия в кислой среде и определить возможность ее протекания в стандартных условиях.
Алгоритм решения.

Окислитель
|
|
2 |
Восстановитель
|
5 |
По таблице находим стандартные потенциалы окислительно-восстановительных пар (таблица 2):
 ;
;

э.д.с.
=Е0ок-ля
- Е0в-ля=
 -
-
 =1,51-0,54=0,96>0
=1,51-0,54=0,96>0
Ответ: значит окислительно-восстановительная реакция протекает самопроизвольно в прямом направлении.
Форма предоставления результата
Выполнение индивидуальных заданий по вариантам: решение задач и упражнений по названной тематике.
Приложения
Таблица 1 – Константы нестойкости некоторых комплексных ионов
Схема диссоциации комплексного иона |
Константа нестойкости |
[HgCl4]2– Hg2+ + 4Cl– |
8,5•10–16 |
[HgBr4]2– Hg2+ + 4Br– |
1,0•10–21 |
[HgJ4]2– Hg2+ + 4J– |
1,5•10–31 |
[Hg(CN)4]2– Hg2+ + 4CN– |
4,0•10–42 |
[Ag(NH3)2]+ Ag+ + 2NH3 |
5,7•10–8 |
[Ag(NO2)2]– Ag+ + 2NO2– |
1,3•10–3 |
[Ag(S2O3)2]3– Ag+ + 2S2O32– |
2,5•10–14 |
[Ag(CN)2]– Ag+ + 2CN– |
1,4•10–20 |
[Cd(NH3)4]2+ Cd2+ + 4NH3 |
7,5•10–8 |
[Cd(CN)4]2– Cd2+ + 4CN– |
1,4•10–19 |
[Cu(NH3)4]2+ Cu2+ + 4NH3 |
2,1•10–13 |
[Cu(CN)4]2– Cu2+ + 4CN– |
5,0•10–31 |
[Zn(NH3)4]2+ Zn2+ + 4NH3 |
3,5•10–10 |
[Zn(CN)4]2– Zn2+ + 4CN– |
2,0•10–17 |
[Fe(CN)6]4– Fe2+ + 6CN– |
1,0•10–37 |
[Fe(CN)6]3– Fe3+ + 6CN– |
1,0•10–44 |
Таблица 2 – Стандатные окислительно-восстановительные потенциалы




