
- •1. Классификация коррозионных процессов
- •2. Электрохимическая коррозия
- •3. Теории коррозии
- •4. Факторы, влияющие на скорость коррозии металлов
- •5. Контактная коррозия металлов
- •6. Агрессивность коррозионных сред
- •7. Обрастание судов и биокоррозия
- •8. Химическая коррозия
- •1. Классификация коррозионных процессов 3
- •Гальванический элемент
- •Концентрационный элемент
- •Алгоритм составления схемы гальванического элемента.
- •Химические источники тока
- •Топливные элементы.
- •Вторичные источники тока
- •Экспериментальная часть
- •Вопросы для самоконтроля по темам: «Электродные потенциалы. Гальванический элемент»
- •Приложение
Гальванический элемент
Гальванические элементы относятся к химическим источникам электрического тока и позволяют получать ток за счет самопроизвольного протекания химической реакции.
Гальваническим элементом называется обратимая электрохимическая система, состоящая из двух электродов, погруженных в раствор электролита, в которой энергия окислительно-восстановительного процесса превращается в электрическую.
Гальванический элемент состоит из двух электродов, различающихся величиной φ-потенциалов. Электрод с меньшим значением φ-потенциала является анодом, а электрод с бỏльшим значением потенциала – катодом.
Устройство и принцип работы гальванического элемента можно рассмотреть на примере электрохимического элемента Якоби-Даниэля (рис. 4).
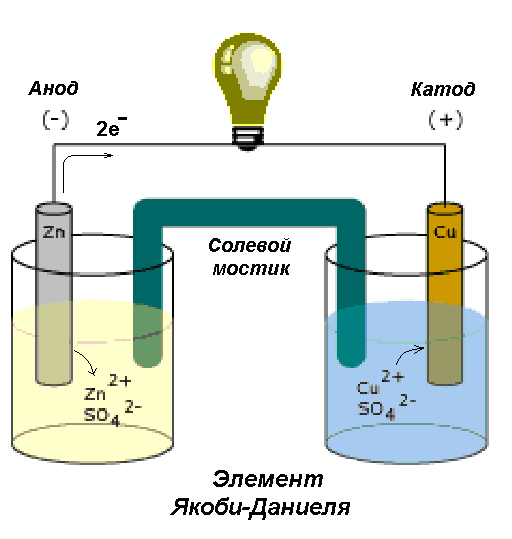
Рис. 4. Устройство элемента Якоби-Даниэля
Такой элемент имеет электроды из цинка и меди, погруженные в сернокислые растворы этих металлов. Емкости соединены между собой солевым мостиком, заполненным раствором хлорида калия (KCl).
При замыкании цепи гальванического элемента между цинковым электродом и раствором электролита идет реакция окисления, т.е. цинковая пластинка растворяется:
![]()
![]()
Ионы цинка из электрода переходят в раствор, а на электроде остаются электроны. Следовательно, цинковая пластинка заряжается отрицательно и становится анодом.
Между медным электродом и окружающим его раствором CuSO4 идет реакция восстановления:
![]()
![]()
Ионы меди из раствора осаждаются на медном электроде, который приобретает положительный заряд и становится катодом.
ЗАПОМНИТЕ! О к и с л е н и е – отдача электронов – происходит н а а н о д е, в о с с т а н о в л е н и е – приобретение электронов – н а к а т о д е. В гальваническом элементе анод имеет знак «-», а катод имеет знак «+».
Для гальванического элемента принята следующая форма записи:

А(-) Zn | ZnSO4 || CuSO4 | Cu (+)К,
где вертикальная линия | обозначает границу раздела фаз, а двойная вертикальная линия || солевой мостик. Гальванический элемент принято записывать так, чтобы анод находился слева.
Источником электрической энергии в элементе служит окислительно-восстановительная реакция, называемая суммарной или разрядной:
Cu2+ + Zn = Cu + Zn2+
или
![]()
Важнейшей характеристикой гальванического элемента является электродвижущая сила (ЭДС), которая определяется как предельная разность потенциалов, возникающая на границе раздела фаз в разомкнутой цепи элемента.
![]()
Э Д С – количественная характеристика эффективности работы гальванического элемента – она показывает, насколько полно осуществляется процесс перехода химической энергии в электрическую.
Величина Е всегда положительна (Е>0).
Для медно-цинкового гальванического элемента ЭДС равна:
![]() ,
т.е.
,
т.е.
![]()
Работа
гальванического элемента связана с
уменьшением энергии Гиббса
![]() G
и может быть представлена как произведение
переносимого электричества на величину
ЭДС:
G
и может быть представлена как произведение
переносимого электричества на величину
ЭДС:
А = - G = nFE, где
![]() -
заряд
катиона;
-
заряд
катиона;
![]() -
число Фарадея,
-
число Фарадея,
![]() -
стандартная ЭДС элемента.
-
стандартная ЭДС элемента.
Концентрационный элемент
В этом элементе электроды изготовлены из одинакового металла и погружены в растворы собственных солей с различной концентрацией. Таким образом, они приобретают одноименный заряд (Рис.5). Например, элемент, содержащий две серебряные пластинки, погружены в растворы нитрата серебра неодинаковой концентрации. При этом пластинка, погруженная в раствор с меньшей концентрацией, является отрицательным электродом, а другая пластинка - положительным.
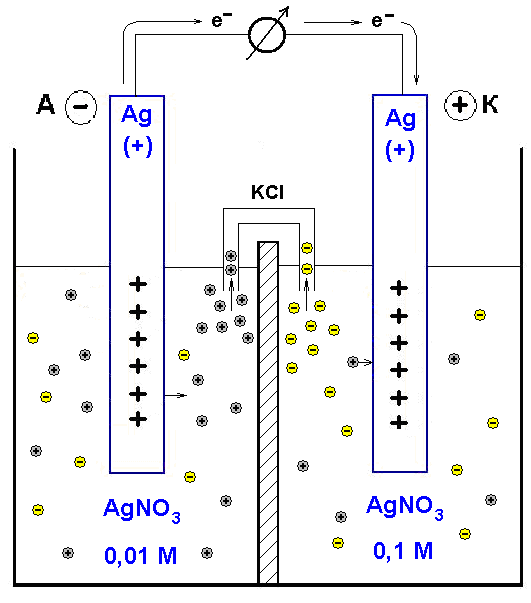
Рис. 5. Схема концентрационного элемента
Следовательно, при замыкании внешней цепи поток электронов устремится слева направо; в результате на правом электроде выделяется серебро, а левый электрод постепенно растворяется.
На отрицательном электроде (аноде) данного элемента протекает окисление серебра
![]()
![]()
А на положительном (катоде) – восстановление ионов раствора
![]()
![]()
При
этом в правой части элемента начнут
накапливаться анионы
![]() ,
а в левой – катионы
,
а в левой – катионы
![]() ,
которые диффундируют навстречу друг
другу через солевой мостик с
,
которые диффундируют навстречу друг
другу через солевой мостик с
![]() .
Источником энергии в концентрационном
элементе является работа по выравниванию
концентраций солей в обоих отделениях
элемента. ЭДС элемента вычисляется по
формуле:
.
Источником энергии в концентрационном
элементе является работа по выравниванию
концентраций солей в обоих отделениях
элемента. ЭДС элемента вычисляется по
формуле:
![]()
где
![]() –
абсолютная температура; n
– валентность иона; С1
и
С2
–концентрации
(активности) ионов серебра в более и
менее концентрированных растворах
соответственно.
–
абсолютная температура; n
– валентность иона; С1
и
С2
–концентрации
(активности) ионов серебра в более и
менее концентрированных растворах
соответственно.
