
- •1. Классификация коррозионных процессов
- •2. Электрохимическая коррозия
- •3. Теории коррозии
- •4. Факторы, влияющие на скорость коррозии металлов
- •5. Контактная коррозия металлов
- •6. Агрессивность коррозионных сред
- •7. Обрастание судов и биокоррозия
- •8. Химическая коррозия
- •1. Классификация коррозионных процессов 3
- •Гальванический элемент
- •Концентрационный элемент
- •Алгоритм составления схемы гальванического элемента.
- •Химические источники тока
- •Топливные элементы.
- •Вторичные источники тока
- •Экспериментальная часть
- •Вопросы для самоконтроля по темам: «Электродные потенциалы. Гальванический элемент»
- •Приложение
Приложение
Таблица № 1 Электрохимический ряд напряжений металлов (стандартные электродные потенциалы)
|
П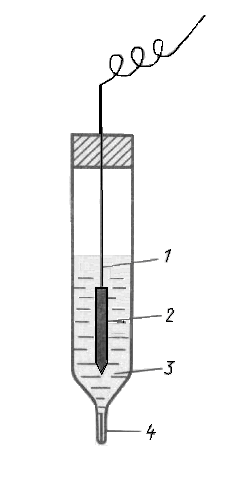 риложение
2
риложение
2
Хлорсеребряный электрод.
1- серебряная проволока; 2 – слой AgCl;
3 – раствор KCl; 4 - микрощель.
Схема записи электрода: Ag|AgCl, KCl насыщ.
Реакция, протекающая на электроде
![]()
или
![]()
Уравнение Нернста для расчета величины электродного потенциала:
![]()
Литература
Глинка Н.Л. Общая химия: Учебник. Л.: Химия. 1985
Коровин Н.В., Масленникова Г.Н. и др. Курс общей химии. М., Высшая школа. 1990.
Химия. Справочные материалы. Под ред. академика Ю.Д.Третьякова. М., «Просвещение». 1994.
Зимон А.Д., Лещенко Н.Ф. Физическая химия. М., Химия. 2000.
Трусов В.И., Соколова Л.Б. Введение в химию для судостроителей. Часть 2. Учебное пособие. С.-Петербург, 1997.
Даниловская Л.П. Электрохимические процессы в технике. Методические указания. С.-Петербург, 1993.
Грицкевич А.И. Решение типовых задач по курсу общей химии. Методические указания. С.-Петербург, 2006.
