
БДЗ по химии / VAR19
.DOCВАРИАНТ 19.
Задание 3.2г
Полная электронная формула:
58Ce 1s22s22p63s23p63d104s24p64d104f25s25p66s2.
Сокращенная электронная формула в виде энергетических ячеек:
58Ce [ ] 4s2 / 4p6 \ / 4d10\ / 4f 2 \ 5s2 / 5p6 \ 6s2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Церий Ce f-элемент; к его электронным аналогам относится торий Th.
Высшая степень окисления церия 4 ; это возбужденное состояние характеризуется следующими значениями квантовых чисел:
58Ce*… 5s2 / 5p6 \ / 5d2 \ 6s1 / 6p1 \
-
n
5
5
6
6
l
2
2
0
1
m
1
1
0
0
s
½
½
½
½
Задание 3.3г
U3O8 ; O2 O2 O2 O2 Все связи ковалентные полярные с долей ионности.
\\ / \ / \ // Степень ионности связи OU4 (разность
U6 U4 U6 электроотрицательностей 2,1) больше, чем связи
// \ / \ / \\ OU6 ( ЭО = 1,6 ).
O2 O2 O2 O2
Pb3O4 ; O2 O2 Все связи ковалентные полярные с долей ионности.
/ \ / \ Степень ионности связи OPb2 ( ЭО = 1,9 )
Pb2 Pb4 Pb2 больше, чем связи OPb4 (ЭО = 1,7 ).
\ / \ /
O2 O2
Fe3O4 ; O2 = Fe3 O2 Fe2 O2 Fe3 = O2 ;
Все связи ковалентные полярные с долей ионности.
Степень ионности связи OFe2 ( ЭО = 1,7 ) больше, чем связи OFe3 (ЭО = 1,6 ).
Задание 3.6д
TiO2(тв) + 2C(графит) Ti(тв) + 2CO(г) ; H298= 722,9 кДж ;
Число моль газообразных веществ в ходе реакции возрастает, следовательно S>0. Поэтому изменение энергии Гиббса G = H298 T·S для этой реакции отрицательно только при высокой температуре, т. е. термодинамически протекание данной реакции возможно при достаточно высокой температуре .
Задание 3.11
Среди перечисленных реакций группу быстрых составляют реакции ионного обмена и взаимодействия радикалов:
в) Ag(р-р) + Cl(р-р) AgCl(тв) ;
г) OH(р-р) + H(р-р) H2O(ж) ;
д) KOH(р-р) + HCl(р-р) KCl(р-р) + H2O(ж) ;
е) H·(г) + H·(г) H2(г) ;
ж) Cl·(г) + Cl·(г) Cl2(г) ;
для этих реакций Eа= 0÷50 кДж.
Группу медленных реакций составляют взаимодействия валентнонасыщенных соединений:
а) C(графит) + O2(г) CO2(г) ;
б) CH4(г) + 2O2(г) CO2(г) + 2H2O(г) ;
для этих реакций Eа= 90÷220 кДж.
Задание 3.16
По уравнению реакции N2O4 = 2NO2 видно, что если из начальных 0,08 моль/л N2O4 диссоциировало 50%, то равновесная концентрация NO2 составит [NO2] = 0,08 моль/л, при этом равновесная концентрация N2O4 составит (100-50)=50% от начальной, т.е. [N2O4] = 0,04 моль/л. Тогда константа равновесия равна :
![]()
![]()
Задание 3.21б
1) Рассмотрим раствор KMnO4 (C = 0,1 моль/л ).Эта соль диссоциирует по уравнению:
KMnO4 K + MnO4, поэтому C(K) = 0,1 моль/л, C(MnO4) = 0,1 моль/л. Найдем ионную силу такого раствора:
![]() =
0,5·[C(K)·z2(K)
+ C(MnO4)·z2(MnO4)]
= 0,5·[0,1·12
+ 0,1·12] = 0,1.
=
0,5·[C(K)·z2(K)
+ C(MnO4)·z2(MnO4)]
= 0,5·[0,1·12
+ 0,1·12] = 0,1.
Используя уравнение первого приближения
теории ДебаяХюккеля,
найдем коэффициент активности y±
: ln y±
=
A·z·z·![]() ,
где A
константа растворителя (Авод=1,174);
,
где A
константа растворителя (Авод=1,174);
ln y±
=
1,174·1·(1)·![]() = 0,371 ; отсюда y±
= 0,69. Тогда активность электролита равна:
a±
=
= 0,371 ; отсюда y±
= 0,69. Тогда активность электролита равна:
a±
=
![]() = 11·11·0,12·0,692
= 0,00476.
= 11·11·0,12·0,692
= 0,00476.
2) Аналогично для раствора UO2SO4.
UO2SO4 UO22 + SO42 ; C(UO22) = 0,1 моль/л, C(SO42) = 0,1 моль/л.
I = 0,5·[C(UO22)·z2(UO22) + C(SO42)·z2(SO42)] = 0,5·[0,1·22 + 0,1·22] = 0,4.
ln y±
=
1,174·2·(2)·![]() = 2,97 ; отсюда y±
= 0,051. Тогда активность электролита
равна: a±
=
= 2,97 ; отсюда y±
= 0,051. Тогда активность электролита
равна: a±
=
![]() = 11·11·0,12·0,0512
= 2,63·105.
= 11·11·0,12·0,0512
= 2,63·105.
Задание 3.36
При электролизе раствора KOH на аноде возможна только одна реакция:
4OH 4e O2 + 2H2O . А на катоде конкурируют два процесса (перенапряжением по условию пренебрегаем ) :
1) K + e K0 , E1= E0(K/K0) = 2,925 B ;
2) 2H2O + 2e H2 + 2OH , E2 = 0,059pH .
Очевидно, что E1<
E2 , поэтому на катоде
идет вторая реакция ( восстановление
водорода ). Тогда суммарная реакция
такова: 2H2O![]() 2H2
+ O2
2H2
+ O2
Задание 3.38
Для разделения соединений тория(IV) и гадолиния(III), исходно находящихся в водном растворе, можно использовать большую склонность тория по сравнению с гадолинием к комплексообразованию. Так, например, добавив в раствор смеси хлоридов тория и гадолиния ( ThCl4 и GdCl3 ) избыток фторида натрия, мы получим осадок фторида гадолиния, в то время как торий останется в растворе в виде комплексного иона, т. е. элементы могут быть отделены друг от друга:
GdCl3 + 3NaF GdF3 + 3NaCl ; Gd3 + 3F GdF3 ;
ThCl4 + 8NaF Na4[ThF8] + 4NaCl ; Th4 + 8F [ThF8]4 .
Задание 3.44д
Согласно протонной теории кислот и оснований Брендстеда, кислота является донором протонов, а основание акцептором протонов. Следовательно, в реакции
HF + H2O = F + H3O
кислоте HF соответствует сопряженное основание F, а основанию H2O сопряженная кислота H3O.
Задание 4.1в
SO3 + H2O H2SO4 ; P2O5 + 3H2O 2H3PO4 ;
Na2SiO3 + H2SO4 Na2SO4 + H2SiO3 ; KOH + HNO3 KNO3 + H2O ;
K2O + 2HClO4 2KClO4 + H2O ; Al2O3 + 3H2SO4 Al2(SO4)3 + 3H2O .
Задание 4.3г
CuCO3 + 2H2O Cu(OH)2 + H2CO3 ( H2CO3 CO2 + H2O ) ;
Pb(NO3)2 + H2O PbOHNO3 + HNO3 , Pb2 + H2O PbOH + H ;
UCl6 + 4H2O U(OH)4Cl2 + 4HCl , U6 + 4H2O U(OH)42 + 4H ;
PCl3+ 3H2O H3PO3 + 3HCl , PCl3+ 3H2O H3PO3 + 3H + 3Cl ;
CaH2 + 2H2O Ca(OH)2 + 2H2 , CaH2 + 2H2O Ca2 + 2OH + 2H2 .
Задание 4.6б
10KBr + 2KMnO4 + 8H2SO4 5Br2 + 2MnSO4 + 6K2SO4 + 8H2O ;
Mn7 + 5e Mn2 ·2 ; E0(Mn7/Mn2) = 1,51 B ;
2Br1 2e Br20 ·5 ; E0(Br2/Br1) = 1,063 B ;
E0 = E0(Mn7/Mn2) E0(Br2/Br1) = 0,447 B.
G0 = z·F·E0 = 431,36 кДж (где z число молей электронов, участвующих в ОВР,
F 96500 Кл постоянная Фарадея).
G0« 0, следовательно, реакция идет в прямом направлении.
6FeSO4 + KClO3 + 3H2SO4 KCl + 3Fe2(SO4)3 + 3H2O ;
Cl5 + 6e Cl1 ·1 ; E0(Cl5/Cl1) = 2,45 B ;
Fe2 e Fe3 ·6 ; E0(Fe3/Fe2) = 0,77 B ;
E0 = E0(Cl5/Cl1) E0(Fe3/Fe2) = 1,68 B.
G0 = z·F·E0 = 972,72 кДж.
G0« 0, следовательно, реакция идет в прямом направлении.
2Ce(OH)4 + 8HCl 2CeCl3 + Cl2 + 8H2O ;
2Cl1 2e Cl20 ·1 ; E0(Cl0/Cl1) = 1,36 B ;
Ce4 + e Ce3 ·2 ; E0(Ce4/Ce3) = 1,61 B ;
E0 = E0(Ce4/Ce3) E0(Cl0/Cl1) = 0,25 B.
G0 = z·F·E0 = 48,25 кДж.
G0« 0, следовательно, реакция идет в прямом направлении.
Задание 4.7а
CuSO4 + 4NH4OH [Cu(NH3)4]SO4 + 4H2O ;
Cu2 + 4NH4 + 4OH [Cu(NH3)4]2 + 4H2O ;
G0 = Gобр([Cu(NH3)4]2) + 4·Gобр(H2O) Gобр(Cu2) 4·Gобр(NH4) 4·Gобр(OH) ;
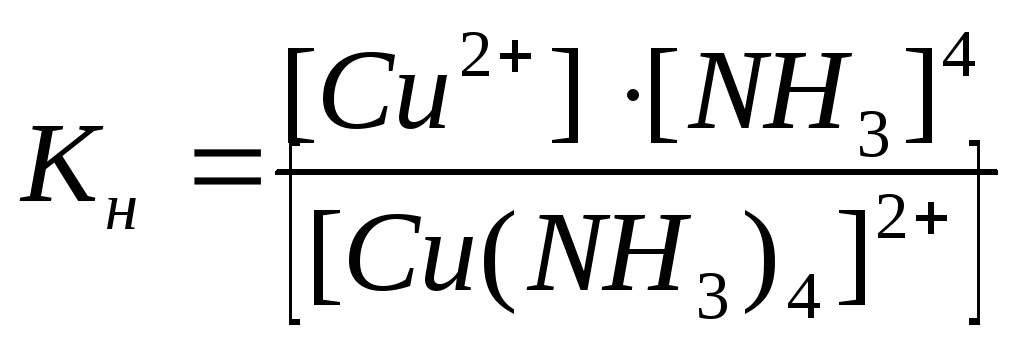
Hg(NO3)2 + 4KI K2[HgI4] + 2KNO3 ;
Hg2 + 4I [HgI4]2 ;
G0 = Gобр([HgI4]2) Gобр(Hg2) 4·Gобр(I) ;
![]()
