
БДЗ по химии / VAR22
.DOCВАРИАНТ 22.
Задание 3.1б.
Согласно правилу Клечковского, заполнение энергетических уровней происходит в порядке возрастания суммы чисел n+l, а при равных значениях n+l – в порядке возрaстания n. То есть для заданной суммы n+l=5 порядок заполнения будет следующим: 3d(n=3, l=2); затем 4p(n=4, l=1); затем 5s(n=5, l=0).
Задание 3.3б.
H2SO3 ; O2 Все связи ковалентные полярные с долей ионности.
|| Степень ионности связи HO (разность
H1O2S4O2H1 электроотрицательностей 1,3) больше, чем связи
SO ( ЭО = 0,9 ).
K2S2O7 ; O2 O2 Связи KO ионные (ЭО = 2,7 ), следовательно,
|| || они обладает большей степенью ионности, чем
K1O2S6O2S6O2K1 ковалентные полярные связи SO (ЭО = 0,9 ).
|| ||
O2 O2
Na2S2O8 ; O2 O2 Связь OO (ЭО = 0 ) ковалентная неполярная;
|| || остальные связи описаны в предыдущем
Na1O2S6O1O1S6O2Na1 пункте ( связь NaO аналогична KO ).
|| ||
O2 O2
Задание 3.5.
а) O(г), 160,8 Дж/(мольК) ; O2(г), 204,86 Дж/(мольК) ; O3(г) , 238,68 Дж/(мольК).
Энтропия в этом ряду возрастает, т.к. усложняется строение молекул (от одноатомных до трехатомных), в результате увеличивается число возможных положений каждой молекулы в пространстве, т.е. возрастает степень хаотичности в расположении всей совокупности молекул.
б) C(алмаз), 2,44 Дж/(мольК) ; C(графит), 5,69 Дж/(мольК).
Энтропия алмаза меньше, чем графита, т.к. в кристаллической решетке алмаза все атомы соединены друг с другом равноценными связями, в то время как кристаллическая решетка графита имеет слоистую структуру, которая обладает гораздо меньшей степенью симметрии и, следовательно, в пространстве может быть реализована большим числом различных способов, что и обуславливает увеличение энтропии графита по сравнению с алмазом.
в) H2O(лед), 43,9 Дж/(мольК) ; H2O(ж), 66,9 Дж/(мольК) ; H2O(г) , 188,7 Дж/(мольК).
Энтропия в этом ряду возрастает, т.к. при переходе от твердой фазы к жидкой и от жидкой к газообразной увеличивается подвижность молекул, т.е. возрастает степень хаотичности системы.
Задание 3.9.
2NO + 2H2 N2 + 2H2O ; V = k [NO]2 [H2]
По кинетическому уравнению легко определить частные порядки по реагирующим веществам: по NO - 2; по H2 - 1.
Общий порядок реакции равен сумме частных порядков, т. е. 3.
Экспериментальные порядки не согласуются со стехиометрическими соотношениями, т. к. данная реакция является сложной.
Задание 3.14д.
CuSO4(р-р) + 4NH3(г) [Cu(NH3)4]SO4(р-р);
Cu2 + 4NH3 [Cu(NH3)4]2 ;
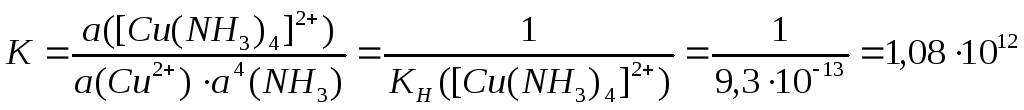
Th(NO3)4(р-р) + 4Na2CO3(р-р) Na4[Th(CO3)4]( р-р) + 4NaNO3(р-р);
Th4 + 4CO32 [Th(CO3)4]4 ;

Задание 3.24.
K4[Fe(CN)6] ; заряд комплексного иона 4; степень окисления комплексообразователя +2;
координационное число 6; уравнение диссоциации: K4[Fe(CN)6] 4K + [Fe(CN)6]4.
K3[Fe(CN)6] ; заряд комплексного иона 3; степень окисления комплексообразователя +3;
координационное число 6; уравнение диссоциации: K3[Fe(CN)6] 3K + [Fe(CN)6]3.
Задание 3.34д.
По табличным данным находим, что E0(Zn2/ Zn0) < E0(Au3/ Au0), следовательно, на катоде идет восстановление золота, а на аноде – окисление цинка. Схема такого гальванического элемента имеет вид:
/ 6e \
Zn0 | Zn2 || Au3 | Au0. Электродные процессы:
на катоде: Au3 + 3e Au0 , E0(Au3/ Au0) = 1,498 B ;
на аноде: Zn0 2e Zn2 , E0(Zn2/ Zn0) = 0,763 B ;
тогда ЭДС равна E = E0(Au3/ Au0) E0(Zn2/ Zn0) = 2,261 B.
Уравнение токообразующей реакции имеет вид:
2Au3 + 3Zn0 2Au0 + 3Zn2 ; 2AuCl3 + 3Zn 2Au + 3ZnCl2 .
Задание 3.41.
Для выделения соединений церия и европия из смеси лантаноидов можно использовать то, что в отличие от других лантаноидов сульфаты этих элементов (в степени окисления +3) хорошо растворимы. Т.е. соответствующие реакции можно записать так:
2Ce(NO3)3 + 3Na2SO4 = Ce2(SO4)3 + 6NaNO3 ;
2Eu(NO3)3 + 3Na2SO4 = Eu2(SO4)3 + 6NaNO3 ;
2La(NO3)3 + 3Na2SO4 La2(SO4)3 + 6NaNO3 (в качестве примера приведен сам лантан).
Т.е. ионы Ce3 и Eu3 остаются в растворе, а другие лантаноиды выпадает в осадок в виде сульфатов, следовательно, могут быть отделены.
Задание 3.45а.
Согласно электронной теории кислот и оснований Льюиса, кислота является акцептором, а основание донором электронов. Следовательно, в реакции
Al3 + 6H2O = [Al(H2O)6]3
Al3 является кислотой Льюиса, а H2O основанием Льюиса.
Задание 4.1а.
Th + O2 ThO2 ; C + O2 CO2 ;
2FeS + 3O2 2FeO + 2SO2 ; CH4 + 2O2 CO2 + 2H2O ;
2Sc(OH)3![]() Sc2O3
+ 3H2O
; La2(CO3)3
Sc2O3
+ 3H2O
; La2(CO3)3![]() La2O3
+ 3CO2
;
La2O3
+ 3CO2
;
Y2(C2O4)3![]() Y2O3
+ 3CO2
+ 3CO
; 2Cu(NO3)2
Y2O3
+ 3CO2
+ 3CO
; 2Cu(NO3)2![]() 2CuO
+ 4NO2
+ O2
.
2CuO
+ 4NO2
+ O2
.
Задание 4.3б.
Al2S3 + 6H2O 2Al(OH)3 + 3H2S ;
Na2HPO4 + H2O = NaOH + KH2PO4 , HPO42 + H2O = OH + H2PO4 ;
Cu(NO3)2 + H2O = CuOHNO3 + HNO3 , Cu2 + H2O = CuOH + H ;
LiH + H2O LiOH + H2 ; LiH + H2O Li + OH + H2 ;
EuC2 + 2H2O Eu(OH)2 + C2H2 .
Задание 4.6в.
K2Cr2O7 + 14HCl(конц) 3Cl2 + 2CrCl3 + 2KCl + 7H2O ;
Cr6 + 3e Cr3 ·2 ; E0(Cr6/Cr3) = 1,33 B ;
2Cl1 2e Cl20 ·3 ; E0(Cl0/Cl1) = 1,36 B ;
E0 = E0(Cr6/Cr3) E0(Cl0/Cl1) = 0,03 B.
G0 = z·F·E0 = 17,37 кДж (где z число молей электронов, участвующих в ОВР,
F 96500 Кл постоянная Фарадея).
G0>0, следовательно, реакция идет в обратном направлении.
4Zn + 10HNO3(разб) NH4NO3 + 4Zn(NO3)2 + 3H2O ;
N5 + 8e N3 ·1 ; E0(N5/N3) = 0,86 B ;
Zn0 2e Zn2 ·4 ; E0(Zn0/Zn2) = 0,763 B ;
E0 = E0(N5/N3) E0(Zn0/Zn2) = 0,097 B.
G0 = z·F·E0 = 74,88 кДж.
G0> 0, следовательно, реакция идет в обратном направлении.
MnSO4 + Br2 + 4NaOH MnO2 + Na2SO4 + 2NaBr+ 2H2O ;
Br20 + 2e 2Br1 ·1 ; E0(Br2/Br1) = 1,063 B ;
Mn2 2e Mn4 ·1 ; E0(Mn4/Mn2) = 0,05 B ;
E0 = E0(Br2/Br1) E0(Mn4/Mn2) = 1,113 B.
G0 = z·F·E0 = 214,8 кДж.
G0« 0, следовательно, реакция идет в прямом направлении.
Задание 4.8б.
K4[Fe(CN)6] + 2ZnSO4 Zn2[Fe(CN)6] + 2K2SO4 ;
mZn2[Fe(CN)6] + nK4[Fe(CN)6] {[mZn2[Fe(CN)6]]n[Fe(CN)6]4xK}(4n-x) (4n-x)K


![]() |
|![]() |
|![]()
![]() |
|
![]()
mAl(OH)3 + nAlCl3 {[mAl(OH)3]nAl3xCl}(3n-x) (3n-x)Cl


![]() |
|![]() |
|![]()
![]() |
|
![]()
