
- •Кафедра физики Кубанского государственного
- •Доктор физико - математических наук Кубанского
- •В.В. Фомин
- •Введение
- •1. Способы осуществления электростимулированной миграции ионов
- •2. Физические процессы, лежащие в основе электростимулированной миграции ионов
- •3. Анализ профиля поперечного сечения волноводов, изготовленных методом электростимулированной миграции ионов
- •Причем это соответствие устанавливается формулой
- •4. Изготовление интегрально-оптических волноводов электростимулированной миграцией ионов
- •4.1. Принципиальная схема установки для проведения электростимулированной миграции ионов
- •4.2. Изготовление интегрально-оптических волноводов электростимулированной миграцией ионов серебра
- •4.3. Исследование влияния стимулирующего напряжения и ширины отверстия в маске на форму и геометрические размеры поперечного сечения формируемых волноводов
- •4.4. Исследование влияния стимулирующего напряжения и ширины отверстия в маске на оптические параметры волноводов
- •4.5. Исследование интегрально-оптических волноводов, полученных электростимулированной миграцией ионов из расплава нитрата калия
- •4.6. Изготовление и исследование заглубленных и двухканальных интегрально-оптических волноводов
- •5. Изготовление интегрально-оптических микролинз и исследование их свойств
- •5.1. Изготовление микролинз электростимулированной миграцией ионов из расплава соли
- •5.2. Изготовление микролинз электростимулированной миграцией ионов из расплава соли
- •5.3. Изготовление и исследование интегральных
- •5.4. Формирование рассеивающих, цилиндрических
- •6. Изготовление матриц микролинз
- •7. Разработка и исследование матриц микролинз с плотной упаковкой
- •7.1. Расчет формы интегральных микролинз в матрицах, получаемых методом электростимулированной миграции ионов в стеклах
- •7.2. Изготовление матриц микролинз с плотной
- •7.3. Разработка и исследование матриц интегральных микролинз для датчика волнового фронта Шака-Гартмана
- •8. Создание и исследование Многоканального микролинзового интегрально-оптического ответвителя излучения
- •Заключение
- •Библиографические ссылки
2. Физические процессы, лежащие в основе электростимулированной миграции ионов
Прежде чем приступить к рассмотрению процессов, имеющих место при проведении электростимулированной миграции ионов из расплава соли в стеклянную подложку, необходимо определить влияние структуры стекла на саму возможность диффузии ионов.
В основе структуры силикатного стекла, т.е. стекла, содержащего в качестве основного компонента кремнезем, лежат ионы (SiO4)4 - , образующие тетраэдры, в центре которых располагается малый ион Si4+ радиусом 0,039 нм, а в вершинах находятся более крупные ионы O2– , имеющие радиус 0,132 нм. Расстояние от центра тетраэдра до центра ионов O2– составляет 0,162 нм, а между соседними ионами O2– – 0,265 нм. На рис. 10 представлен внешний вид такого тетраэдра.
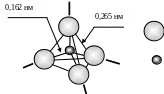
– ион O2–
– ион Si4+
Рис. 10. Внешний вид тетраэдра (SiO4)4 -
Соединяясь друг с другом вершинами, эти тетраэдры образуют непрерывную в одном, двух или трех измерениях пространственную структуру. Взаимным расположением тетраэдров в структуре, их упорядоченностью определяются основные свойства материала. Правильно упорядоченные тетраэдры образуют правильную кристал -лическую решетку, характерную для кристаллического кварца (рис. 11а), что предопределяет анизотропность его свойств. В то же время в кварцевом стекле (плавленом кварце) наблюдается неупорядоченное расположение тетраэдров (рис. 11б) и изотропность свойств наряду с отсутствием ярко выраженной температуры плавления, присущей кристаллическим материалам.

а б
Рис. 11. Кристаллическая решетка кристаллического (а)
и плавленого (б) кварца
В общем случае в центре кислородных тетраэдров могут находиться и другие стеклообразователи (B, P, Ge), при этом стекла носят названия боратных, фосфатных или германатных [54–56].
Как правило, большое число таких тетраэдров (многогранников) имеют общие вершины, занятые так называемыми мостиковыми ионами кислорода. Ионы кислорода, принадлежащие лишь одному полиэдру, называются «немостиковыми» ионами кислорода. В промежутках структурной сетки могут находиться некоторые положительные ионы (преобразующие сетку), например: Li+, Na+, K+, Ba2+, Ca2+, Mg2+. Эти катионы, не способные самостоятельно образовывать непрерывную структурную сетку, называются модификаторами. Катионы модификаторов располагаются в свободных полостях структурной сетки, компенсируя избыточный отрицательный заряд сетки, обусловленный наличием «немостиковых» ионов кислорода. Кислородное окружение катионов модификаторов формируется в соответствии с их координационными требованиями. Прочность связи модификатор – кислород значительно ниже прочности связи стеклообразователь – кислород, поэтому модификаторы не образуют прочных координационных групп. Так, например, прочность связи кислорода с кремнием равна 443 кДж/моль, а прочность связи кислорода с натрием равна 84 кДж/моль, с калием – 54 кДж/моль. Структурная сетка натрий-силикатного стекла более рыхлая и менее связанная, чем сетка кварцевого стекла, в ней крупнее промежутки и полости, в которых располагаются ионы натрия (рис. 12).
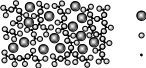
– ион Na+
– ион О2
– ион Si4+
Рис. 12. Структурная сетка натрий-силикатного стекла
Структурную сетку стекла часто характеризуют следующими величинами: R – среднее число ионов кислорода на один образующий структурную сетку ион; X – среднее число «немостиковых» ионов кислорода на полиэдр;
Y – среднее число «мостиковых» ионов кислорода на полиэдр.
Если ограничиться рассмотрением силикатных стекол, которые имеют лишь тетраэдры кислорода, то будут справедливы следующие соотношения:
X + Y = 4. (1)
X
+
![]() Y
= R.
(2)
Y
= R.
(2)
Откуда
X = 2R – 4. (3)
Y = 8 – 2R. (4)
У плавленого кварца все ионы кислорода – «мостиковые» (R = 2, Y = 4). Поэтому он имеет жесткую сетку. Атом кремния в кварце окружен четырьмя атомами кислорода, расположенными симметрично в вершинах тетраэдра. Тетраэдры не образуют в пространстве геометрически правильных соединений, характерных для решеток кристаллических модификаций кварца. Несмотря на это, плавленый кварц обладает довольно «плотной» структурой по сравнению со стеклами, имеющими более низкие значения Y. Структуры кристаллического и плавленого кварца не являются плотноупакованными, так как тетраэдры соединяются вершинами, а не ребрами и не гранями. В кварцевом стекле имеются свободные структурные полости, ограниченные в пространстве «мостиковыми» ионами кислорода.
Если в структурную сетку SiO2 ввести некоторое количество окиси металла, например Na2O, то определенное число «мостиковых» ионов кислорода будет замещено таким же числом пар «немостиковых» ионов кислорода, что приведет к уменьшению Y. Вследствие этого структурная сетка стекла становится менее прочной, степень сцепления сетки уменьшается, а сетка при этом разрыхляется. Это значит, что промежутки между тетраэдрами, а также «окна» между ними увеличиваются, что способствует довольно легкой диффузии ионов различных, чаще всего щелочных, металлов в стекло.
Диффузия происходит за счет разности концентраций диффундирующих веществ. Так если у поверхности стекла концентрация ионов какого-либо щелочного металла С0, а в стекле С = 0, то эти ионы будут диффундировать в направлении их меньшей концентрации, т.е. в стеклянную подложку.
Математическое описание диффузионных процессов было сделано в 1855 г. немецким ученым А.Фиком в виде двух законов, основанных на уравнениях теплопроводности.
Уравнение, характеризующее скорость диффузии атомов одного вещества в другое при постоянном во времени потоке этих атомов и градиенте их концентрации, носит название первого закона Фика.
![]() ,
(5)
,
(5)
где
![]() –
вектор плотности потока атомов вещества;
D
– коэффициент пропорциональности, или
коэффициент диффузии;
–
вектор плотности потока атомов вещества;
D
– коэффициент пропорциональности, или
коэффициент диффузии;
![]() –
вектор градиента концентрации
диффундирующих атомов [57].
–
вектор градиента концентрации
диффундирующих атомов [57].
Коэффициент диффузии D определяет плотность потока атомов диффундирующего вещества при заданном градиенте концентрации. Так как диффузионный поток атомов вещества идет в направлении выравнивания перепада концентрации, то коэффициент диффузии D является мерой скорости, с которой система способна при заданных условиях выравнять разность концентраций, и имеет размерность (см2/с). Эта скорость зависит только от подвижности диффундирующих атомов в матрице стекла. Коэффициент диффузии существенно зависит от температуры. Чем выше температура, тем больше энергия диффундирующих атомов и их скорость в кристаллической решетке стекла. Эта зависимость выражается уравнением Аррениуса
![]() ,
(6)
,
(6)
где D0 – постоянная, имеющая размерность (см2/с) и зависящая от структуры стекла, размеров и валентности диффундирующих ионов и других параметров, определяющих процесс диффузии, т.е. кажущийся коэффициент диффузии при Т , который не зависит от температуры и определяется экспериментально в каждом конкретном случае; Е – энергия активации, т.е. энергия, необходимая атому для диффузии; k – постоянная Больцмана; Т – абсолютная температура.
Градиент концентрации С при объемной диффузии имеет три составляющих по координатным осям. Однако если глубина диффузии значительно меньше поперечных размеров площади, через которую она происходит, то мы вправе рассматривать процесс диффузии как одномерный, т.е. направленный нормально к поверхности подложки. При этом первый закон Фика примет вид
![]() .
(7)
.
(7)
Из закона сохранения массы следует, что изменение во времени C(x, t) равно отрицательному приращению потока J.
![]() ,
(8)
,
(8)
откуда следует второй закон Фика
![]() .
(9)
.
(9)
Второй закон Фика определяет скорость изменения концентрации диффундирующих атомов в любой плоскости, перпендикулярной направлению диффузии. В случае, если С мало, а D является постоянной величиной, второй закон Фика принимает вид
![]() .
(10)
.
(10)
Это уравнение имеет несколько решений в зависимости от граничных условий. На практике чаще всего рассматриваются два случая диффузии: диффузия из бесконечного источника и диффузия из конечного источника внедряемых атомов.
Под бесконечным (постоянным) источником понимают такое состояние системы, когда количество атомов, уходящих из приповерхностного слоя подложки в ее объем, равно количеству атомов, поступающих в приповерхностный слой. Таким является источник с бесконечно большим содержанием атомов, которые в нем имеют существенно более высокие скорости, чем в подложке. Начальное и граничное условия в этом случае записываются следующим образом:
C(x, t) = 0 при x 0, t = 0,
C(0, t) = Cs при x = 0, t 0, (11)
C(, t) = 0 при x , t 0.
Здесь x – расстояние, измеряемое вглубь от поверхности подложки; x = 0 – координата поверхности, через которую происходит диффузия; Cs – приповерхностная концентрация диффундирующих атомов, поддерживаемая постоянной в течение всего процесса; C(x, t) – концентрация атомов на любой глубине подложки и в любое время; t – время диффузии.
При этих условиях решение уравнения второго закона Фика имеет вид
 ,
(12)
,
(12)
где – переменная интегрирования.
Второй член в квадратных скобках представляет собой выражение функции ошибок, поэтому последнее уравнение можно записать следующим образом:
![]() ,
(13)
,
(13)
или
![]() ,
(14)
,
(14)
где erfc – символ, означающий дополнение функции ошибок до единицы.
Э та
формула описывает распределение
концентрации диффузанта в стеклянной
подложке в зависимости от глубины
проникновения и времени процесса в
случае, если диффузия проводится из
неограниченного источника. Графическое
представление этого распределения
приведено на рис. 13.
та
формула описывает распределение
концентрации диффузанта в стеклянной
подложке в зависимости от глубины
проникновения и времени процесса в
случае, если диффузия проводится из
неограниченного источника. Графическое
представление этого распределения
приведено на рис. 13.
Рис. 13. Распределение концентрации диффузанта по
глубине при проведении диффузии из
неограниченного источника
Данный вид диффузии (диффузии из неограниченного источника) имеет место в том случае, если стеклянная подложка приводится в соприкосновение с расплавом соли, содержащим диффундирующие ионы, и при этом наиболее подвижные ионы стекла обмениваются на ионы расплава.
При проведении диффузии из ограниченного источника, что наблюдается при твердотельной диффузии из тонкой металлической пленки, нанесенной на поверхность подложки, поверхностная концентрация диффузанта меняется с течением времени. При этом начальные условия таковы:
![]() при
0
x
d
при
0
x
d
![]() при
x
d.
(15)
при
x
d.
(15)
С учетом этих начальных условий решение уравнения второго закона Фика имеет вид
![]() ,
(16)
,
(16)
где Q – общее количество внедренных в подложку атомов в любой момент времени.
Это уравнение представляет собой функцию распределения (закон) Гаусса и показывает распределение концентрации диффузанта в зависимости от глубины и времени (рис.14).

Рис. 14. Распределение концентрации диффузанта по
глубине при проведении диффузии из
ограниченного источника
Максимальное значение приповерхностной концентрации Cs ограничивается предельной концентрацией наиболее подвижных ионов стекла, участвующих в процессе ионного обмена (Li+, Na+, K+), в случае проведения диффузии из неограниченного источника, т.е. из расплава соли. Если же диффузия проводится из металлической пленки, то Cs будет ограничиваться пределом растворимости диффундирующих ионов в матрице стекла.
Диффузия ионов при наличии стимулирующего электрического поля описывается следующим уравнением:
![]() ,
(17)
,
(17)
где
![]() – подвижность ионов в стекле; Е –
напряженность электрического поля
[58].
– подвижность ионов в стекле; Е –
напряженность электрического поля
[58].
Решение этого уравнения для граничных условий С(x, 0) = 0 при х 0 и С(0, t) = Сs при t 0 имеет вид
![]() .
(18)
.
(18)
Если пренебречь вкладом от процесса тепловой диффузии, то в случае проведения электростимулированной миграции ионов из неограниченного источника распределение концентрации внедренных в стекло ионов приобретает ступенчатый характер (рис. 15). Здесь же пунктиром показано распределение концентрации внедренных в стекло ионов при отсутствии электрического поля.
0

Рис. 15. Распределение концентрации диффузанта по глубине при проведении электростимулированной миграции
из неограниченного источника
Поскольку
в процессе электростимулированной
миграции ионов в стеклянной подложке
происходит изменение химического
состава, то и показатель преломления
в области диффузии также претерпевает
изменение
![]()
![]() .
Отсюда следует, что профиль изменения
показателя преломления имеет в этом
случае ступенчатую форму, что и
подтверждается многочисленными
экспериментами.
.
Отсюда следует, что профиль изменения
показателя преломления имеет в этом
случае ступенчатую форму, что и
подтверждается многочисленными
экспериментами.
