
Влияние концентрации азота на ростовые характеристики культуры Cupriavidus Eutropus
.docxФедеральное государственное автономное
образовательное учреждение
высшего образования
«СИБИРСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ»
Институт Фундаментальной Биологии и Биотехнологии
Базовая кафедра биотехнологии
ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ
«Культивирование микроорганизмов и выделение полимера»
|
Руководитель |
|
|
|
|
|
|
|
|
|
|
|
подпись, дата |
|
инициалы, фамилия
|
|
Студент |
|
|
|
|
|
|
|
|
|
номер группы |
|
подпись, дата |
|
инициалы, фамилия |
Красноярск 2019
Цель работы: экстрагировать полимер из культуры Cupriavidus eutrophus.
Ход работы и методы
1. Культивирование бактерий и методы измерения параметров культивирования
Бактерии Cupriavidus eutrophus B-10646 выращивали в стеклянных колбах объемом 0,5л, заполненных культурой на 40% объема на термостатируемой качалке при температуре 30оС. Для выращивания бактерий за основу был взят фосфатный буфер следующего состава (г/л): Na2HPO4 . H2O – 9,1; KH2PO4 – 1,5. Также в буфер были добавлены следующие растворы: MgSO4 . H2O – 0,2; (2 мл) Fe3C6H5O7 . 7H2O – 0,25; (1 мл) NH4Cl – 1,0 (2 мл); стандартный раствор микроэлементов по Хоагланду (из расчета 3 мл стандартного раствора на 1 л среды) стандартный раствор содержит: H3BO3 – 0,228; CoCe26H2O – 0,030; СuSO4 5H2O – 0,008; MnCe24H2O – 0,008; ZnSO47H2O – 0,176; NaMoO42H2O – 0,050; NiCe2 – 0,008 (г/л)) (0.6 мл).
В качестве источника углерода использовалась фруктоза, было добавлено 15 мл фруктозы (250 гр/литр)
Периодически отбирали пробы культуры и измеряли оптическую плотность на фотоколориметре при λ=440нм и длине оптического пути 1мм (малая кювета). Для этого делали разведение культуры с дистиллированной водой в соотношении 1:5.
Биомассу бактерий в культуре определяли весовым способом. Для этого 20-25 мл бактериальной суспензии центрифугировали 8 мин на 6000 оборотах в центрифуге. Затем дважды отмывали клетки от солей дистиллированной водой и снова центрифугировали. Отмытые клетки переносили в бюксы, предварительно доведенные до постоянного веса. Бюксы сушили при температуре 105о С в сушильном шкафу в течение 24 ч, охлаждали и взвешивали. Биомассу бактерий определяли, как разницу между весом бюкса с клетками и весом чистого бюкса.
2.Определение концентрации фруктозы
Концентрацию фруктозы определяли резорциновым методом. Для этого супернатант разводили в 25 раз. Из разведения 1 мл пробы наливали в пробирку, куда добавляли: 1 мл спиртового раствора резорцина (1 г резорцина растворяли в 100 мл 95% этилового спирта); 3 мл 80% раствора соляной кислоты. В качестве контроля брали: 1 мл дистиллированной воды, 1 мл спиртового раствора резорцина, 3 мл 30%-го раствора соляной кислоты. Пробирки с контролем и пробой помещали на водяную баню на 20 мин., при t=80oC. По истечении этого времени пробирки охлаждали до комнатной температуры и измеряли оптическую плотность на фотоколориметре Unico при λ=540 нм (длина оптического пути 5 мм). Концентрацию фруктозы рассчитывали по калибровочному графику.
3. Определение содержания в клетках состава ПГА
Внутриклеточную концентрацию и состав ПГА определяли хроматографией метиловых эфиров жирных кислот после предварительного метанолиза образцов (навеска 3,9-4,5 мг) на хромато-масс-спектрометре. Метанолиз проб полимера проводили следующим образом: к навеске сухой биомассы (3,9-4,5 мг) добавляли 1 мл внутреннего стандарта (0,5 мг бензойной кислоты/1 мл хлороформа), 0,85 мл метанола и 0,15 мл концентрированной серной кислоты и кипятили с обратными холодильниками в течение 2 часов 40 минут. По окончании метанолиза в колбу добавляли 1 мл дистиллированной воды.
4. Определение содержания аммонийного азота
Для определения содержания аммонийного азота к 10 мл дистиллированной воды добавляли 1 мл фугата, каплю щелочи (33%-го раствора КОН) и 0,5 мл реактива Несслера. В результате полученный раствор изменял свой цвет в зависимости от содержания азота. Окраску сравнивали со стандартом.
Результаты
Таблица 1 – Результаты эксперимента
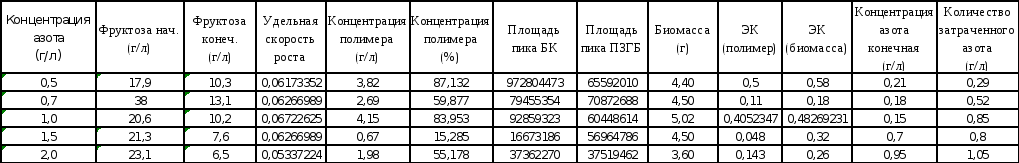
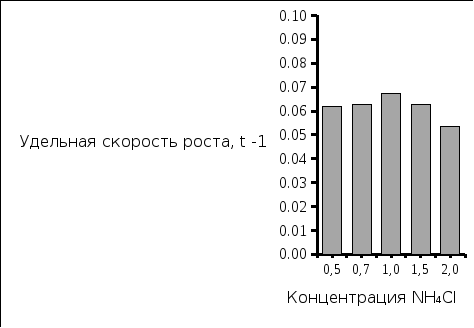

Рис.1. Удельная скорость роста культуры Рис. 2. Количество затраченного азота

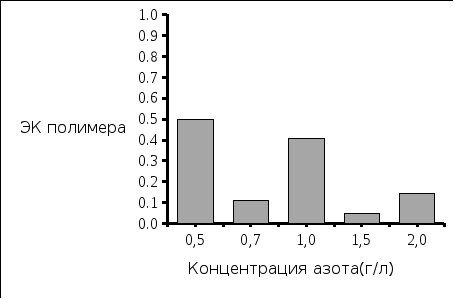
Рис. 3. Экономический коэфициент выхода биомассы Рис. 4. Экономический коэфициент выхода полимера
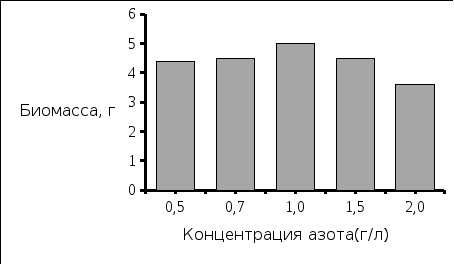
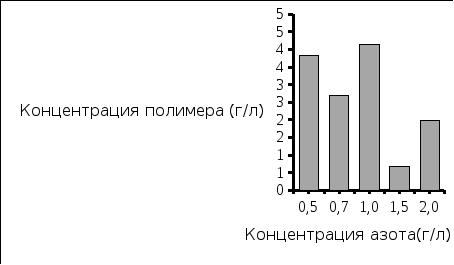
Рис. 5. Концентрация полученной биомассы Рис. 6. Концентрация выделенного полимера
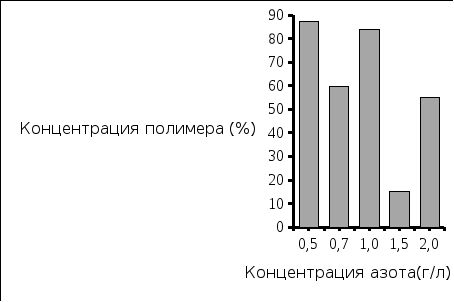
Рис.7. Количество выделенного полимера
Вывод: Наибольшая концентрация полимера была выделена при исходной концентрации азота 1,0 г/л, и соответствует значению 4,15 г/л. Экономический коэффициент при этом имеет значение 0,4.
