
- •Строение атома
- •Химическая связь
- •Энергетика химических процессов
- •Химическое равновесие
- •Гидролиз
- •Химическая кинетика
- •Растворы
- •Растворы
- •Дисперсные системы и коллоидные растворы
- •Кислотно-основные системы
- •Комплексные соединения
- •Электрохимические процессы
- •Гальванические элементы
- •Электролиз
- •Коррозия металлов
- •План характеристики свойств элемента
- •Водород
- •Свойства европия.
- •Методы получения лантаноидов
- •Свойства урана.
- •Физические методы разделения
- •Химические транспортные реакции
- •Разделение редкоземельных элементов
Электрохимические процессы
Окислительно-восстановительные реакции состоят из процессов окисления и восстановления. Окисление/восстановление — отдача/принятие электронов веществом. Окислитель/восстановитель — вещество, отдающее/принимающее электроны в реакции. Степень окисления — число электронов, смещённых от атома данного элемента или к атому данного элемента в соединении. Химический способ осуществления ОВР — непосредственная передача электронов от восстановителя к окислителю. В этом случае G < 0. Электрохимический способ осуществления ОВР. Отличается тем, что полуреакции пространственно разделены, т. е. хаотический перенос электронов преобразуется в направленный процесс переноса электронов от восстановителя через внешнюю цепь к окислителю и, как следствие этого, превращение химической энергии в электрическую. Электрохимические процессы протекают в окислительно-восстановительных (ОВ) системах, где происходят процессы превращения химической энергии в электрическую и наоборот. В основе всех ЭХП лежат процессы переноса заряженных частиц из одной фазы в другую, сопровождающиеся образованием ДЭС и разности потенциалов (электролит/электрод: электродного (ж/тв), контактного (тв/тв) и диффузионного (ж/ж)) на границе раздела фаз. Двойной электрический слой (ДЭС) — тонкий поверхностный слой из пространственно разделённых зарядов противоположных знаков, образующихся на границе раздела фаз. ДЭС образуется в результате: 1) Обмена ионами между металлом и раствором электролита. оложительные ионы из металла отрываются водой и переносятся в раствор. 2) Адсорбция ионов на поверхности электрода. 3) Выход электронов из кристаллической решётки электрода. Основные элементы электрохимической системы: Электроды (металлы, полупроводники) Электролиты с ионной проводимостью (раствор, расплав, твёрдое вещество) Граница раздела фаз (электролит | электрод).
Гальванические элементы
Проводник 1 рода
— имеющий электронную проводимость.
Проводник
2 рода —
имеющий ионную проводимость (раствор).
Электрод
— проводник 1 рода, находящийся в контакте
с ионным проводником.
Электрод
1 рода —
металл/неметалл, погружённый в раствор,
содержащий ионы данного
еталла/неметалла.
Электрод
2 рода —
металл, покрытый слоем труднорастворимой
соли и погружённый в электролит,
содержащий ионы этой соли.
Гальванический
элемент —
электрохимическая система, в которой
химическая энергия преобразуется в
электрическую.
Состоит
из двух электродов, соединённых
проводниками первого или второго рода
в замкнутую цепь.
Электродный
потенциал
— относительный равновесный электродный
потенциал, измеренный по отношению к
условной точке отсчёта (
одородного
электрода = 0).
0
—
относительный стандартный электродный
потенциал по водородной шкале.
Уравнение
Нернста:
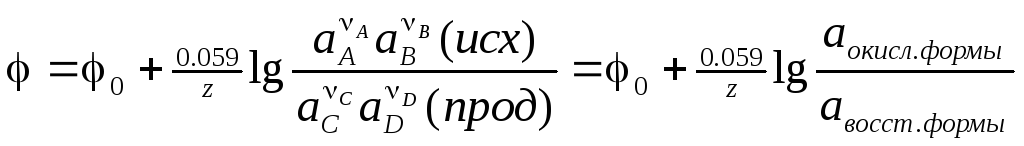 .
ЭДС
гальванического элемента
E
= катода
– анода
= E0
+ (1/z)
* 0,059 * lg
(aкатода
/ aанода).
Связь
ЭДС и энергии Гиббса:
G
= -nFE. Отсюда
можно делать выводы относительно
направления
протекания реакций ОВР: G
< 0: прямая реакция возможна.
Правила
записи гальванических элементов.
В ГЭ ЭДС
всегда > 0.
.
ЭДС
гальванического элемента
E
= катода
– анода
= E0
+ (1/z)
* 0,059 * lg
(aкатода
/ aанода).
Связь
ЭДС и энергии Гиббса:
G
= -nFE. Отсюда
можно делать выводы относительно
направления
протекания реакций ОВР: G
< 0: прямая реакция возможна.
Правила
записи гальванических элементов.
В ГЭ ЭДС
всегда > 0.
Слева записывают электрод с меньшим потенциалом. Zn- (анод) | ZnSO4 || CuSO4 | Cu (катод) Типы гальванических элементов: Стандартные: Водородный электрод. (H+/H2) = 0. Всегда. Кислородный электрод. OH- | O2, Pt. 4OH- – 4e- O2 + 2H2O. = 1,277 – 0,059pH. Обратимые: ГЭ, в которых прямая токообразующая реакция и обратная (потребление электрической энергии) представляют собой одну и ту же взаимообратимую реакцию. Zn | ZnSO4 Электродные потенциалы не зависят от механизма образования двойного электрического слоя, а зависит от природы электрода и активности ионов, участвующих в электродной реакции. 0 — справочная величина (по водородной шкале). Чем больше 0, тем сильнее окислительные свойства. Внимание! Если один из электродов —стандартный водородный, то он записывается на первом месте: Pt, H2 | H+ || Cu2+ | Cu0, E > 0. Pt, H2 | H+ || Zn2+ | Zn0, E < 0.
