
- •Первичная структура белка, связи ее стабилизирующие, биологическая роль.
- •Генетическая информация, основные виды ее переноса.
- •Центральный постулат молекулярной генетики.
- •Репликация. Инициация, элонгация, терминация, их механизмы.
- •Транскрипция, понятие, характеристика транскриптона и оперона. Условия, необходимые для транскрипции.
- •Генетический (аминокислотный) код, его свойства.
- •Свойства
- •Инициация, элонгация и терминация трансляции. Образование инициаторного комплекса. Цикл элонгации, его энергетика.
- •Понятие о ферментах. Свойства ферментов как биокатализаторов.
- •Активный центр ферментов, его структурно-функциональная неоднородность. Единицы активности ферментов.
- •Механизм действия ферментов. Значение образования фермент субстратного комплекса в процессе катализа.
- •Уравнение скорости ферментативной реакции Михаэлиса и Ментен. Константа Михаэлиса (Км), определение, характеристика.
- •Зависимость скорости реакции от концентрации субстрата, температуры и рН среды.
- •1)От концентрации субстракта:
- •2)От температуры
- •3)От pH среды
- •Механизм действия активаторов и ингибиторов на скорость реакции. Ингибиторы, их типы.
- •Полиферментные комплексы. Аллостерические ферменты, их структура и роль.
- •Изоферменты, множественные молекулярные формы ферментов, их свойства, регуляторная функция.
- •Цикл трикарбоновых кислот, химизм, энергетический эффект, внутриклеточная локализация и регуляция.
- •Липиды. Их классификация и функции
- •Жирные кислоты: строение, свойства и функции.
- •Простагландины, их биологическая роль.
- •Понятие о гормонах, их классификация, свойства и механизм действия.
- •Структура ц-амф, биологическая роль. Регуляция содержания цАмф в клетках
- •Стероидные гормоны. Структура, биологичекая роль, механизм действия.
- •Строение, биологическая роль, механизм действия тиреоидных гормонов.
- •Инсулин, строение, биологическая роль, механизм действия.
- •Гормоны мозгового слоя надпочечников, строение, биологическая роль, механизм действия (на примере адреналина).
- •Строение, роль гормонов гипоталамуса и гипофиза.
- •Половые гормоны, их структура, механизм действия, биологическая роль.
- •Витаминоподобные вещества: строение, свойства и функции в организме.
- •Антивитамины: строение, свойства и механизм действия.
Механизм действия ферментов. Значение образования фермент субстратного комплекса в процессе катализа.
Активный центр является гибкой структурой по отношению к субстрату. Субстрат, взаимодействуя с активным центром фермента, вызывает изменение его конформации, приводя к формированию фермент-субстратного комплекса, благоприятного для химических модификаций субстрата. При этом молекула субстрата также изменяет свою конформацию, что обеспечивает более высокую эффективность ферментативной реакции.
Уравнение скорости ферментативной реакции Михаэлиса и Ментен. Константа Михаэлиса (Км), определение, характеристика.
Зависимость скорости (v) ферментативного превращения субстрата от его концентрации [S] описывается уравнением Михаэлиса – Ментен:
K![]() M
– константа Михаэлиса, характеризующая
активность фермента
V – максимальная
скорость реакции при данной суммарной
концентрации фермента.
M
– константа Михаэлиса, характеризующая
активность фермента
V – максимальная
скорость реакции при данной суммарной
концентрации фермента.
Константа Михаэлиса - она соответствует концентрации субстрата, при которой скорость реакции равна половине максимальной и служит мерой химического сродства меду ферментом и субстратом, мерой их способности образовывать фермент-субстратный комплекс.
Зависимость скорости реакции от концентрации субстрата, температуры и рН среды.
1)От концентрации субстракта:
г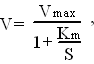 де
V -скорость ферментативной реакции
Vmax - максимальная скорость ее при
бесконечно большой концентрации
субстрата,
де
V -скорость ферментативной реакции
Vmax - максимальная скорость ее при
бесконечно большой концентрации
субстрата,
S - концентрация субстрата в моль/л,
Кm - константа Михаэлиса
2)От температуры
До некоторого значения температуры каталитическая активность растет. В то же время постепенно возрастает количество инактивированного фермента за счет денатурации его белковой части. При температуре выше температурного оптимума денатурация ферментного белка резко усиливается и, хотя скорость реакций преобразования субстрата продолжает расти, активность фермента, выражающаяся количеством превращенного субстрата, падает.
3)От pH среды
Д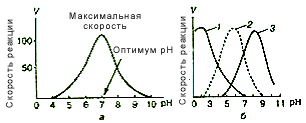 ля
каждого фермента существует оптимальное
значение рН среды, при котором он
проявляет максимальную активность.
Большинство ферментов имеет максимальную
активность в зоне рН поблизости от
нейтральной точки. В резко кислой или
резко щелочной среде хорошо работают
лишь некоторые ферменты.
ля
каждого фермента существует оптимальное
значение рН среды, при котором он
проявляет максимальную активность.
Большинство ферментов имеет максимальную
активность в зоне рН поблизости от
нейтральной точки. В резко кислой или
резко щелочной среде хорошо работают
лишь некоторые ферменты.
Механизм действия активаторов и ингибиторов на скорость реакции. Ингибиторы, их типы.
Ингибиторами называют вещества, вызывающие частичное или полное торможение химических реакций, включая и ферментативные.
Активаторами называют вещества, увеличивающие каталитическую активность ферментов.
Механизм действия ингибиторов может быть самым разнообразным, но в общей форме можно сказать, что ингибитор вступает в соединение с ферментом, образуя соединение фермент-ингибитор.
Различают обратимое и необратимое ингибирование фермента. При обратимом ингибировании активность фермента восстанавливается по мере удаления свободного ингибитора. При необратимом ингибировании равновесие между свободным ингибитором и ферментом не устанавливается и активность фермента не удается восстановить диализом.
Обратимое ингибирование ферментативных реакций бывает конкурентным и неконкурентным.
Конкурентное ингибирование может быть вызвано веществами, похожими по своей структуре на субстрат. Эти вещества, конкурируя с субстратом, соединяются с активным центром фермента, но не подвергаются ферментативному превращению и новые продукты из них не образуются. В связи с тем, что часть фермента при конкурентном ингибировании расходуется на образование комплеса фермент-ингибитор, скорость ферментативной реакции снижается. Конкурентное ингибирование обратимо, так как при увеличении концентрации субстрата скорость реакции возрастает.
Неконкурентное ингибирование вызывают вещества, не имеющие структурного сходства с субстратом. Причем эти вещества обратимо присоединяются к ферменту не в активном центре, где обычно связывается субстрат, а совсем в другом месте и, следовательно, конкуренция между субстратом и ингибитором отсутствует. Связываясь с ферментом, неконкурентные ингибиторы вызывают изменение пространственной структуры активного центра, и, хотя присоединение субстрата к такому активному центру происходит, тем не менее катализ становится невозможным.
Усиление активности ферментов под действием ионов металлов(активаторы) объясняется тем, что в одних случаях ионы металлов выполняют роль кофактора, в других - облегчают образование фермент-субстратного комплекса, в третьих - способствуют присоединению кофермента к апоферменту, в четвертых обеспечивают становление четвертичной структуры фермента или же действуют иными путями.
